题目内容
2.欲探究某矿石可能是由FeCO3、SiO2、Al2O3中的一种或几种组成,探究过程如图所示.已知:碳酸不能溶解Al(OH)3沉淀.
(1)试剂a是NaOH溶液.
(2)无色滤液与盐酸反应生成胶状沉淀的离子方程式是SiO32-+2H+=H2SiO3↓.
(3)该矿石的组成是FeCO3、SiO2.
(4)若处理该矿石2.36kg,得到滤渣1.2kg,理论上至少需要1mol L-1 HNO3的体积为33.3L.
分析 矿石加硝酸生成气体,可说明含有FeCO3,二氧化硅是和硝酸不反应的物质,所以得到的滤渣是二氧化硅,一定存在二氧化硅,滤渣溶解后加入盐酸生成硅酸胶状沉淀,碳酸亚铁和硝酸之间反应得到含有铁离子的盐溶液,只能加入氢氧化钠才能产生氢氧化铁沉淀,加入过量NaoH溶液后通入过量二氧化碳没有沉淀生成,说明没有Al2O3,根据物质的组成和性质进行推断.
解答 解:矿石加硝酸生成气体,可说明含有FeCO3,二氧化硅是和硝酸不反应的物质,所以得到的滤渣是二氧化硅,一定存在二氧化硅,滤渣溶解后加入盐酸生成硅酸胶状沉淀,碳酸亚铁和硝酸之间反应得到含有铁离子的盐溶液,只能加入氢氧化钠才能产生氢氧化铁沉淀,加入过量NaoH溶液后通入过量二氧化碳没有沉淀生成,说明没有Al2O3.
(1)碳酸亚铁和硝酸之间反应得到含有铁离子的盐溶液,只能加入氢氧化钠才能产生氢氧化铁沉淀,所以试剂a是NaOH溶液,故答案为:NaOH溶液;
(2)二氧化硅是和硝酸不反应的物质,所以得到的滤渣是二氧化硅,滤渣加入氢氧化钠溶解后,得到硅酸钠溶液,加入盐酸生成硅酸胶状沉淀,即SiO32-+2H+=H2SiO3↓,故答案为:SiO32-+2H+=H2SiO3↓;
(3)根据以上分析,该矿石的组成是:FeCO3、SiO2,故答案为:FeCO3、SiO2;
(4)若处理该矿石2.36kg,得到滤渣二氧化硅1.2kg,所以碳酸亚铁的质量是:2.36kg-1.2kg=1.16kg=1160g,物质的量是:10mol,和稀硝酸之间反应得到含有铁离子的盐溶液,并产生NO气体,根据电子守恒,设理论上至少需要1mol L-1 HNO3的体积为x,则:10mol(3-2)=1mol/L×x(5-2),解得x=33.3L,故答案为:33.3.
点评 该题综合考查粗硅的制备、元素周期律的应用、物质的检验、氧化还原反应方程式的书写、尾气处理和原料的使用以及有关计算,是高考中的常见题型,难度较大,试题综合性强,侧重对学生能力的培养和解题方法的指导,有助于培养学生逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.该试题还通过鼓励学生去大胆的猜想及拓展探究实验,考查学生的基本科学素养.该类试题综合性强,理论和实践的联系紧密,有的还提供一些新的信息,这就要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论.

| A. | V1=10V2 | B. | V1>10V2 | C. | V1<10V2 | D. | V2>10V1 |
| A. | 42.0g | B. | 21.3g | C. | 7.1g | D. | 3.55g |
| A. | 向亚磷酸溶液中加入过量的烧碱溶液(亚磷酸是二元弱酸):H3PO3+3OH-═PO33-+3H2O | |
| B. | 2mol•L-1的AlCl3溶液和7mol•L-1的NaOH溶液等体积混合:2Al3++7OH-═Al(OH)3↓+AlO${\;}_{2}^{-}$+2H2O | |
| C. | 用硝酸酸化的硝酸铁溶液可以刻蚀银饰:Fe3++Ag═Fe2++Ag+ | |
| D. | H218O中投入Na2O2固体:2H218O+2Na2O2═4Na++4OH-+18O2 |
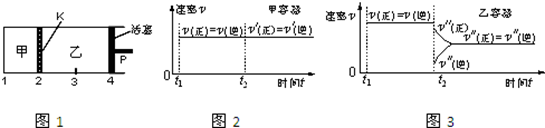
| A. | 保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中 C的浓度的2倍 | |
| B. | 保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数均增加 | |
| C. | 保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍 | |
| D. | 保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略) |
| A. | 与水反应 | B. | 与氢氧化钠溶液反应 | ||
| C. | 与硫酸反应 | D. | 与前三种物质均能反应 |