题目内容
4.下列反应的离子方程式正确的是( )| A. | 向亚磷酸溶液中加入过量的烧碱溶液(亚磷酸是二元弱酸):H3PO3+3OH-═PO33-+3H2O | |
| B. | 2mol•L-1的AlCl3溶液和7mol•L-1的NaOH溶液等体积混合:2Al3++7OH-═Al(OH)3↓+AlO${\;}_{2}^{-}$+2H2O | |
| C. | 用硝酸酸化的硝酸铁溶液可以刻蚀银饰:Fe3++Ag═Fe2++Ag+ | |
| D. | H218O中投入Na2O2固体:2H218O+2Na2O2═4Na++4OH-+18O2 |
分析 A.亚磷酸是二元弱酸,则反应生成的是HPO32-;
B.设溶液体积为1L,则氯化铝的物质的量为2mol,氢氧化钠的物质的量为7mol,2mol铝离子消耗6mol氢氧根离子生成2mol氢氧化铝,剩余的1mol氢氧根离子能够溶解1mol氢氧化铝,则反应后生成1mol氢氧化铝和1mol偏铝酸钠;
C.硝酸的氧化性大于铁离子,硝酸优先氧化银;
D.Na2O2加入到足量H218O中,过氧化钠既做氧化剂又做还原剂.
解答 解:A.向亚磷酸溶液中加入过量的烧碱溶液,由于亚磷酸是二元弱酸,则反应生成HPO32-和水,正确的离子方程式为:H3PO3+2OH-═HPO32-+2H2O,故A错误;
B.2mol•L-1的AlCl3溶液和7mol•L-1的NaOH溶液等体积混合,设溶液体积为1L,则氯化铝的物质的量为2mol,氢氧化钠的物质的量为7mol,2mol铝离子消耗6mol氢氧根离子生成2mol氢氧化铝,剩余的1mol氢氧根离子能够溶解1mol氢氧化铝,则反应后生成1mol氢氧化铝和1mol偏铝酸钠,反应的离子方程式为:2Al3++7OH-═Al(OH)3↓+AlO2+2H2O,故B正确;
C.硝酸酸化的硝酸铁溶液中,硝酸的氧化性大于铁离子,硝酸优先氧化银,发生反应的离子方程式为:3Ag+NO3-+4H+═3Ag++NO↑+2H2O,故C错误;
D.H218O中投入Na2O2固体中,过氧化钠既做氧化剂又做还原剂,正确的离子方程式:2Na2O2+2H218O═4Na++418OH-+O2↑,故D错误;
故选B.
点评 本题考查了离子方程式的判断,为高考的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.

 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案| A. | 标准状况下,22.4 LBr2所含溴原子的数目为2NA | |
| B. | 常温下,NO2与足量的水反应生成0.1molNO,转移的电子数为0.2NA | |
| C. | 1 mol 乙醇中含有的C-H键的数目为6NA | |
| D. | 1mol•L-1的NaClO溶液中含有的ClO-数目小于NA |
| A. | 高锰酸钾溶液与乙二酸(草酸)反应:2MnO4-+5C2O42-+16H+═2Mn2++10CO2↑+8H2O | |
| B. | 在NH4HSO4溶液中慢慢滴入等物质的量的NaOH溶液:NH4++OH-═NH3•H2O | |
| C. | VO2+与酸性高锰酸钾溶液反应:5VO2++MnO4-+H2O═5VO2++Mn2++2H+ | |
| D. | AgNO3溶液中加入过量氨水:Ag++NH3•H2O═AgOH↓+NH4+ |
| 选项 | 实验操作(或设计) | 实验现象 | 结论 |
| A | 向溶液中滴加经盐酸酸化的BaCl2溶液 | 溶液中产生白色沉淀 | 溶液中含有SO42- |
| B | 以镁、铝、氢氧化钠溶液构成原电池 | 镁表面有气泡产生 | 镁作原电池的负极 |
| C | 加热盛有NH4Cl固体的试管 | 试管底部固体消失,试管口有晶体凝结 | NH4Cl固体可以升化 |
| D | 向KI溶液中滴入少量溴水和苯,振荡、静置 | 上层溶液呈紫红色 | I-的还原性强于Br- |
| A. | A | B. | B | C. | C | D. | D |
| A. | Na+、Cu2+、NO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$ | B. | H+、K+、HCO${\;}_{3}^{-}$、Ca2+ | ||
| C. | Ba2+、Mg2+、OH-、Cl- | D. | Fe3+、NH${\;}_{4}^{+}$、S2-、Cl- |
| 弱酸化学式 | CH3COOH | HCLO | H2CO3 |
| 电离平衡常数(25℃) | 1.75×10-5 | 3.0×10-8 | K1=4.4×10-7 K2=4.7×10-11 |
(1)物质的量浓度为0.1mol•L-1的下列 4 种物质,pH 最大的是A.
A.NaCO3 B.NaCLO C.CH3COONa D.NaHCO3
(2)若增大氯水中次氯酸的浓度,不宜向氯水中加入的物质是A.
A.Na2CO3 B.NaCLO C.CH3COONa D.NaHCO3
(3)常温下0.1mol•L-1的CH3COOH 溶液加水稀释过程,下列表达式的数据一定变小的是
A.
A.c(H+) B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ C.c(H+)c(OH-) D.$\frac{c(O{H}^{-})}{c({H}^{+})}$
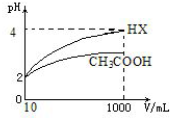
(4)体积为10mLpH=2 的醋酸溶液与一元酸HX 分别加水稀释至1000mL,稀释过程pH 变
化如下图所示,则HX 的酸性大于(填“大于”“等于”或“小于”)醋酸的酸性;稀释后,
HX 溶液中水电离出来的c(H+)大于醋酸溶液水电离出来c(H+)(填“大于”“等于”或“小于”).
(5)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中
?c(CH3COO-)-c(Na+)=1.0×10-6-1.0×10-8mol/L.(填准确数值)