题目内容
17.向体积为2L的密闭容器中加入2molSO2和1molO2,进行可逆反应2SO2+O2?2SO3 反应2min后,测得O2的物质的量为0.8mol,则加热(1)2min内,SO2的物质的量减少了0.4mol,SO3的物质的量增加了0.4mol
(2)若用O2的浓度变化来表示该反应的反应速率,则V(O2)=0.05mol/(L•min)
(3)若用SO3的浓度变化来表示该反应的反应速率,则V(SO3)=0.1mol/(L•min).
分析 (1)先计算出氧气减少的物质的量,然后利用方程式计算出2min内二氧化硫减少、三氧化硫增加的物质的量;
(2)根据n=$\frac{\frac{△n}{V}}{△t}$计算出用O2的浓度变化来表示该反应的反应速率;
(3)根据化学反应速率与计量数成正比计算出用SO3的浓度变化来表示该反应的反应速率.
解答 解:(1)反应2min后,测得O2的物质的量为0.8mol,则氧气的物质的量变化为:1mol-0.8mol=0.2mol,根据反应方程式2SO2+O2?2SO3可知,二氧化硫减少的物质的量为:0.2mol×2=0.4mol,三氧化硫增加的物质的量为:0.2mol×2=0.4mol,
故答案为:0.4mol;0.4mol;
(2)用O2的浓度变化来表示该反应的反应速率为:v(O2)=$\frac{\frac{0.2mol}{2L}}{2min}$=0.05mol/(L•min),
故答案为:0.05mol/(L•min);
(3)反应速率之比等于化学计量数之比,则v(SO3)=2v(O2)=2×0.05mol/(L•min)=0.1mol/(L•min),
故答案为:0.1mol/(L•min).
点评 本题考查了化学平衡的计算,题目难度中等,明确化学反应速率的概念及表达式为解答关键,注意掌握化学反应速率与化学计量数的关系,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.为研究沉淀的生成及其转化,某小组进行如下实验.关于该实验的分析不正确的是( )
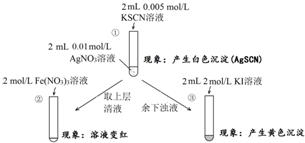

| A. | ①浊液中存在平衡:AgSCN(s)?Ag+(aq)+SCN-(aq) | |
| B. | ②中颜色变化说明上层清液中含有SCN- | |
| C. | ③中颜色变化说明有AgI生成 | |
| D. | 该实验可以证明AgI比AgSCN更难溶 |
2.由于金属锌本身的价值不高,在我国工业锌废料的回收利用率比较低.某课题组研究利用含少量铜、铁的粗锌制备硫酸锌及相关物质的资源综合利用,其工艺流程图(图中加入的物质均为足量)及有关数据如下:
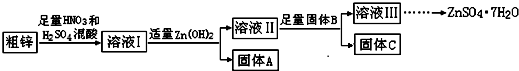
请回答下列问题:
(1)固体A的主要成分是Fe(OH)3;加入固体B的主要作用是将Cu2+(或铜)从溶液Ⅱ中分离出来.
(2)粗锌中的铜与稀混酸溶液反应的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O.
(3)若溶液II中c(Cu2+)为0.05mol•L-1,则溶液II的pH≤5.
(4)若B是Zn,取8.320gC完全溶解于500mL 1mol•L-1稀硝酸中,共收集到2240mL气体,再向所得溶液中加入NaOH溶液至刚好生成沉淀最多,此时所得沉淀质量(m)的取值范围是14.7~14.85g;若B是另一种物质,取部分C于试管中,加入盐酸后产生了有臭鸡蛋味气体,则该反应的离子方程式为ZnS+2H+=Zn2++H2S↑.
(5)溶液III还可以与(NH4)2S溶液反应制备ZnS,实际生产中选用(NH4)2S溶液而不是Na2S溶液作为反应物,是因为后者制得的ZnS中会含有较多的Zn(OH)2杂质.

| 物质 | Fe(OH)3 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS |
| Ksp | 4.0×10-38 | 5.0×10-20 | 2.0×10-16 | 8.5×10-45 | 1.2×10-23 |
(1)固体A的主要成分是Fe(OH)3;加入固体B的主要作用是将Cu2+(或铜)从溶液Ⅱ中分离出来.
(2)粗锌中的铜与稀混酸溶液反应的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O.
(3)若溶液II中c(Cu2+)为0.05mol•L-1,则溶液II的pH≤5.
(4)若B是Zn,取8.320gC完全溶解于500mL 1mol•L-1稀硝酸中,共收集到2240mL气体,再向所得溶液中加入NaOH溶液至刚好生成沉淀最多,此时所得沉淀质量(m)的取值范围是14.7~14.85g;若B是另一种物质,取部分C于试管中,加入盐酸后产生了有臭鸡蛋味气体,则该反应的离子方程式为ZnS+2H+=Zn2++H2S↑.
(5)溶液III还可以与(NH4)2S溶液反应制备ZnS,实际生产中选用(NH4)2S溶液而不是Na2S溶液作为反应物,是因为后者制得的ZnS中会含有较多的Zn(OH)2杂质.
6.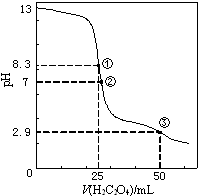 25℃时,用0.0500mol•L-1H2C2O4(二元弱酸)溶液滴定25.00mL0.1000mol•L-1NaOH溶液所得滴定曲线如图.下列说法正确的是( )
25℃时,用0.0500mol•L-1H2C2O4(二元弱酸)溶液滴定25.00mL0.1000mol•L-1NaOH溶液所得滴定曲线如图.下列说法正确的是( )
 25℃时,用0.0500mol•L-1H2C2O4(二元弱酸)溶液滴定25.00mL0.1000mol•L-1NaOH溶液所得滴定曲线如图.下列说法正确的是( )
25℃时,用0.0500mol•L-1H2C2O4(二元弱酸)溶液滴定25.00mL0.1000mol•L-1NaOH溶液所得滴定曲线如图.下列说法正确的是( )| A. | 点①所示溶液中:c(H+)+c(H2C2O4)+c(HC2O4-)=c(OH-) | |
| B. | 点②所示溶液中:c(HC2O4-)+2c(C2O42-)=c(Na+) | |
| C. | 点③所示溶液中:c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-) | |
| D. | 滴定过程中可能出现:c(Na+)>c(C2O42-)=c(HC2O4-)>c(H+)>c(OH-) |
7.下列关于酒精的说法,正确的是( )
| A. | 难挥发 | B. | 不能与水互溶 | C. | 能燃烧 | D. | 不能和乙酸反应 |
 请按要求回答下列问题.
请按要求回答下列问题.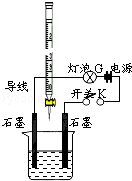 有酸溶液A,pH=a;碱溶液B,pH=b.为测定A、B混合后溶液导电性的变化以及探究A、B的相关性质,某同学设计了如图所示的实验装置.常温下,水的离子积Kw=1×10-14.
有酸溶液A,pH=a;碱溶液B,pH=b.为测定A、B混合后溶液导电性的变化以及探究A、B的相关性质,某同学设计了如图所示的实验装置.常温下,水的离子积Kw=1×10-14.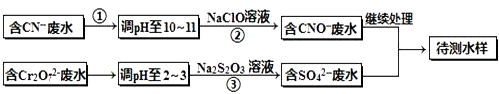
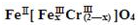 (铁氧磁体,罗马数字表示元素价态)的沉淀.
(铁氧磁体,罗马数字表示元素价态)的沉淀.