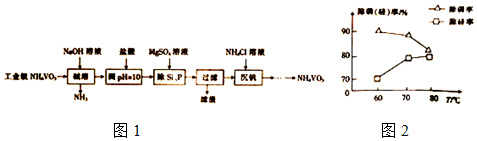
题目内容
16.设NA为阿伏加德罗常数值.下列有关叙述正确的是( )| A. | 常温常压下,等质量的N2和CO气休的原子数均为2NA | |
| B. | 在反应KC1O4+8HCI=KCl+4Cl2↑+4H2O中,每生成4molCl2转移的电子数为8NA | |
| C. | 含有3mol离子的过氧化钠固体和足量的水反应,电子转移数为NA | |
| D. | 标准状况下,80gSO3中含3NA个氧原子,体积约为22.4L |
分析 A.缺少氮气和NO的质量,无法计算含有原子数;
B.反应中生成4mol氯气转移了7mol电子;
C.过氧化钠的化学式中含有3个离子,则含有3mol离子的过氧化钠固体的物质的量为1mol,1mol过氧化钠与水反应生成0.5mol氧气,转移了1mol电子;
D.标准状况下,三氧化硫的状态不是气体.
解答 解:A.等质量的N2和CO具有相同的物质的量,没有告诉具体质量,则无法计算二者含有原子数,故A错误;
B.反应KClO4+8HCl=KCl+4Cl2↑+4H2O中生成4mol氯气转移了7mol电子,则每生成4molCl2转移的电子数为7NA,故B错误;
C.含有3mol离子的过氧化钠固体的物质的量为1mol,1mol过氧化钠和足量的水反应生成0.5mol氧气,转移电子的物质的量为1mol,电子转移数为NA,故C正确;
D.标况下三氧化硫不是气体,不能使用标况下的气体摩尔体积计算三氧化硫的体积,故D错误;
故选C.
点评 本题考查阿伏加德罗常数的计算与判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确标况下气体摩尔体积的使用条件为解答关键,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
7.NA表示阿伏伽德罗常数,下列说法中正确的是( )
| A. | 标况下,22.4升的H2O含有的水分子数为NA | |
| B. | 标况下,11.2升CCl4中含有的Cl原子数为2NA | |
| C. | 17克NH3中含有的电子总数为10NA | |
| D. | 0.5mol/L的H2SO4溶液中含有的H+数为NA |
4.(1)在25℃时,HSCN、HClO、H2CO3的电离常数如表:
①1mol•L-1的KSCN溶液中,所有离子的浓度由大到小的顺序为c(K+)>c(SCN-)>c(OH-)>c(H+).
②向Na2CO3溶液中加入过量HClO溶液,反应的化学方程式为Na2CO3+HClO=NaHCO3+NaClO.
③25℃时,为证明HClO为弱酸,某学习小组的同学设计了以下三种实验方案.下列三种方案中,你认为能够达到实验目的是ac(填字母).
a.用pH计测量0.1mol•L-1NaClO溶液的pH,若所得pH>7,可证明HClO为弱酸
b.用pH试纸测量0.01mol•L-1HClO溶液的pH,若测得pH>2,可证明HClO为弱酸
c.用仪器测量浓度均为0.1mol•L-1的HClO溶液和盐酸的导电性,若测得HClO溶液的导电性弱于盐酸,可证明HClO为弱酸
(2)①肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.联氨溶于水可以发生与氨水类似的电离.试写出联氨在水溶液中的电离方程式N2H4+H2O?N2H5++OH-(写一步即可).
②NH4+在溶液中能发生水解反应.在25℃时,0.1mol•L-1的氯化铵溶液由水电离出的氢离子浓度为1×10-5mol•L-1,则在该温度下此溶液中氨水的电离平衡常数Kb(NH3•H2O)=1×10-5.
| HClO | HSCN | H2CO3 |
| K=3.2×10-8 | K=0.13 | K1=4.3×10-7 K2=5.6×10-11 |
②向Na2CO3溶液中加入过量HClO溶液,反应的化学方程式为Na2CO3+HClO=NaHCO3+NaClO.
③25℃时,为证明HClO为弱酸,某学习小组的同学设计了以下三种实验方案.下列三种方案中,你认为能够达到实验目的是ac(填字母).
a.用pH计测量0.1mol•L-1NaClO溶液的pH,若所得pH>7,可证明HClO为弱酸
b.用pH试纸测量0.01mol•L-1HClO溶液的pH,若测得pH>2,可证明HClO为弱酸
c.用仪器测量浓度均为0.1mol•L-1的HClO溶液和盐酸的导电性,若测得HClO溶液的导电性弱于盐酸,可证明HClO为弱酸
(2)①肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.联氨溶于水可以发生与氨水类似的电离.试写出联氨在水溶液中的电离方程式N2H4+H2O?N2H5++OH-(写一步即可).
②NH4+在溶液中能发生水解反应.在25℃时,0.1mol•L-1的氯化铵溶液由水电离出的氢离子浓度为1×10-5mol•L-1,则在该温度下此溶液中氨水的电离平衡常数Kb(NH3•H2O)=1×10-5.
11.S(单斜)和S(正交)是硫的两种同素异形体已知:
①S(单斜,s)+O2(g)=SO2(g)△H1=-297.16kJ•mol-1
②S(正交,s)+O2(g)=SO2(g)△H2=-296.83kJ•mol-1
③S(单斜,s)=S(正交,s)△H3
④S(正交,s)=S (g)△H4
⑤S(单斜,s)=S (g)△H5
下列说法正确的是( )
①S(单斜,s)+O2(g)=SO2(g)△H1=-297.16kJ•mol-1
②S(正交,s)+O2(g)=SO2(g)△H2=-296.83kJ•mol-1
③S(单斜,s)=S(正交,s)△H3
④S(正交,s)=S (g)△H4
⑤S(单斜,s)=S (g)△H5
下列说法正确的是( )
| A. | 单斜硫转化为正交硫需要吸热 | B. | 单斜硫比正交硫稳定 | ||
| C. | △H4>△H5 | D. | △H4<0 |
1.将1.52g铜镁合金完全溶解于50mL密度为1.40g•mL-1、质量分数为63%的浓硝酸得到NO2和N2O4的混合气体1120mL(标准状况),向反应后的溶液中加入1.0mol•L-1NaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀.下列说法不正确的是( )
| A. | 该合金中铜与镁的物质的量之比是2:1 | |
| B. | 该浓硝酸中HNO3的物质的量浓度是14.0 mol•L-1 | |
| C. | 得到2.54g沉淀时,加入NaOH溶液的体积是600L | |
| D. | NO2和N2O4的混合气体中,NO2的体积分数是80% |
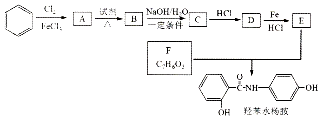
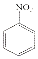 $→_{HCl}^{Fe}$
$→_{HCl}^{Fe}$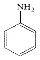
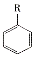 (R-烷基)$\stackrel{KMnO_{4}/H+}{→}$
(R-烷基)$\stackrel{KMnO_{4}/H+}{→}$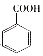
 +2NaOH$→_{△}^{H_{2}O}$
+2NaOH$→_{△}^{H_{2}O}$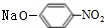 +NaCl+H2O.
+NaCl+H2O. .
.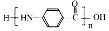 的合成路线
的合成路线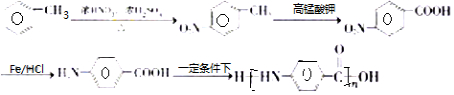 .
. 在含有弱电解质的溶液中,往往有多个化学平衡共存.
在含有弱电解质的溶液中,往往有多个化学平衡共存. 乙酸乙酯广泛用于药物、染料、香料等工业,中学化学实验常用装置来制备.
乙酸乙酯广泛用于药物、染料、香料等工业,中学化学实验常用装置来制备.