题目内容
17.设NA代表阿伏加德罗常数(NA)的数值,下列说法正确的是( )| A. | 1 mol 硫酸钾中阴离子所带电荷数为NA | |
| B. | 将0.1mol氯化铁溶于1L水中,所得溶液含有0.1NAFe3+ | |
| C. | 乙烯和环丙烷(C3H6)组成的28g混合气体中含有3NA个氢原子 | |
| D. | 标准状况下,22.4L氯气与足量氢氧化钠溶液反应转移的电子数为NA |
分析 A.1mol硫酸钾中含有1mol硫酸根离子,带有2mol负电荷;
B.铁离子部分水解,导致铁离子数目减少;
C.根据二者最简式CH2计算含有H原子的物质的量及数目;
D.氯气与氢氧化钠溶液的反应中,氯气既是氧化剂又是还原剂,1mol氯气完全反应转移1mol电子.
解答 解:A.1 mol 硫酸钾中含有1mol硫酸根离子,1mol硫酸根离子带有2mol负电荷,则阴离子所带电荷数为2NA,故A错误;
B.将0.1mol氯化铁溶于1L水中,由于铁离子水解,则所得溶液含有Fe3+数目小于0.1NA,故B错误;
C.乙烯和环丙烷(C3H6)的最简式为CH2,则28g混合气体中含有最简式CH2的物质的量为:$\frac{28g}{14g/mol}$=2mol,含有H原子的物质的量为4mol,所以28g该混合气体中含有4NA个氢原子,故C错误;
D.标准状况下,22.4L氯气的物质的量为1mol,1mol氯气与足量氢氧化钠溶液反应生成1mol氯化钠和1mol次氯酸钠,转移了1mol电子,转移的电子数为NA,故D正确;
故选D.
点评 本题考查阿伏加德罗常数的综合应用,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,试题有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
7.NA表示阿伏伽德罗常数,下列说法中正确的是( )
| A. | 标况下,22.4升的H2O含有的水分子数为NA | |
| B. | 标况下,11.2升CCl4中含有的Cl原子数为2NA | |
| C. | 17克NH3中含有的电子总数为10NA | |
| D. | 0.5mol/L的H2SO4溶液中含有的H+数为NA |
12.下列关系互为同分异构体的是( )
| A. | 35 C1和37Cl | B. | CH3CH2CH2 CH3和CH (CH3)3 | ||
| C. | CH3CH3和CH3CH2CH3. | D. | H2O和H2O2 |
9.漂白粉的主要成分是CaCl2和( )
| A. | Ca(ClO3)2 | B. | Ca(ClO)2 | C. | NaClO | D. | NaHCO3 |
 在含有弱电解质的溶液中,往往有多个化学平衡共存.
在含有弱电解质的溶液中,往往有多个化学平衡共存. 乙酸乙酯广泛用于药物、染料、香料等工业,中学化学实验常用装置来制备.
乙酸乙酯广泛用于药物、染料、香料等工业,中学化学实验常用装置来制备.
 +HCl
+HCl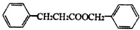 ;检验M中官能团的试剂是银氨溶液或新制备氢氧化铜浊液.
;检验M中官能团的试剂是银氨溶液或新制备氢氧化铜浊液.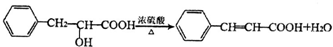 ,
, .
.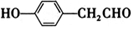 .
.