题目内容
7.雾霾已经成为社会各界共同关注的热门话题,其中汽车尾气和燃煤尾气是造成空气污染的原因之一.(1)汽车尾气净化的主要原理为:2NO(g)+2CO(g)$\stackrel{催化剂}{?}$2CO2(g)+N2(g)
①该反应在低温下能自发进行,该反应的△H< 0.(选填“>”、“<”)
②在某一绝热、恒容的密闭容器中充入一定量的NO、CO发生上述反应,测得正反应的速率随时间变化的曲线如图1所示(已知:t2-tl=t3-t2).
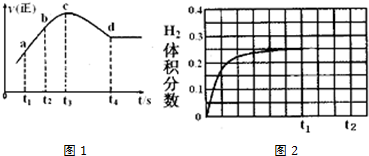
则下列说法不正确的是D.(填编号)
A.反应在c点未达到平衡状态
B.反应速率a点小于b点
C.反应物浓度a点大于b点
D.NO的转化率:t1~t2>t2~t3
(2)煤的综合利用有利于减少环境污染.合成氨工业原料气的来源之一水煤气法,在催化剂存在条件下有下列反应:
C(s)+H2O(g)?CO(g)+H2(g)△H1
H2O(g)+CO(g)?CO2(g)+H2(g)△H2
C(s)+2H2O(g)?CO2(g)+2H2(g)△H3
①△H3和△H1、△H2的关系为△H3=△H1+△H2.
②在恒温条件下,将l mol CO和1mol H2O(g)充入某固定容积的反应容器,达到平衡时有50%的CO转化为CO2.在t1时保持温度不变,再充入1mol H2O(g),请在图2中画出t1时刻后H2的体积分数变化趋势曲线.(t2时刻重新达到平衡)
分析 (1)①根据△G=△H-T△S判断,△G<0,反应自发进行;
②c点反应速率还再变化,而不是固定不变,只有不再随时间的变化而变化,才是平衡状态;经分析该反应是放热反应,反应刚开始时温度升高对正反应速率的影响大于浓度减小对正反应速率的影响,所以图象开始阶段反应速率逐渐增大;随着反应的进行,反应物的浓度逐渐减小;NO的转化量,看tl~t2段<t2~t3段的斜率大小判断.
(2)①根据盖斯定律可知△H3=△H1+△H2;
②H2O(g)+CO(g)?CO2(g)+H2(g)
起始量 1 1 0 0
转化量 0.5 0.5 0.5 0.5
平衡量 0.5 0.5 0.5 0.5
平衡常数k=$\frac{0.5×0.5}{0.5×0.5}$=1;
有50%的CO转化为CO2;则n(H2)=n(CO)转化=0.5mol,刚充入1mol H2O时氢气的体积分数为$\frac{0.5}{3}$=$\frac{1}{6}$;
但是平衡向右移动,设达新平衡时氢气的物质的量为x,
H2O(g)+CO(g)?CO2(g)+H2(g)
2 1 0 0
x x x x
2-x 1-x x x
k=$\frac{{x}^{2}}{(2-x)(1-x)}$=1
x=$\frac{2}{3}$
新平衡时氢气的体积分数为$\frac{\frac{2}{3}}{3}$=$\frac{2}{9}$;
故图象的起点为$\frac{1}{6}$,终点为$\frac{2}{9}$.
解答 解:(1)①由热化学反应方程式可知,该反应为熵减小过程,即△S>0,要使反应在低温下能够自发进行,必须满足△G=△H-T△S<0,可知反应放热△H<0,
故答案为:<;
②A.根据图象可知c点反应速率还再变化,因此不是平衡状态,故A正确;
B.反应刚开始时温度升高对正反应速率的影响大于浓度减小对正反应速率的影响,开始阶段反应速率逐渐增大,反应速率a点小于b点,故B正确;
C.随着反应的进行,反应物的浓度逐渐减小,所以a点反应物的浓度大于b点,故C正确;
D.根据曲线的斜率:tl~t2段<t2~t3段,可知t2~t3段反应速率快,反应物的转化率大,故D错误;
故答案为:D;
(2)下列反应:
C(s)+H2O(g)?CO(g)+h2(g)△H1
H2O(g)+CO(g)?CO2(g)+H2(g)△H2
C(s)+2H2O(g)?CO2(g)+2H2(g)△H3
①根据盖斯定律可知△H3=△H1+△H2,故答案为△H1+△H2;
②H2O(g)+CO(g)?CO2(g)+H2(g)
起始量 1 1 0 0
转化量 0.5 0.5 0.5 0.5
平衡量 0.5 0.5 0.5 0.5
平衡常数k=$\frac{0.5×0.5}{0.5×0.5}$=1;
有50%的CO转化为CO2;则n(H2)=n(CO)转化=0.5mol,刚充入1mol H2O时氢气的体积分数为$\frac{0.5}{3}$=$\frac{1}{6}$;
但是平衡向右移动,设达新平衡时氢气的物质的量为x,
H2O(g)+CO(g)?CO2(g)+H2(g)
2 1 0 0
x x x x
2-x 1-x x x
k=$\frac{{x}^{2}}{(2-x)(1-x)}$=1
x=$\frac{2}{3}$
新平衡时氢气的体积分数为$\frac{\frac{2}{3}}{3}$=$\frac{2}{9}$;
故图象的起点为$\frac{1}{6}$,终点为$\frac{2}{9}$;tl时刻后H2的体积分数变化趋势曲线为 ,
,
故答案为: .
.
点评 本题考查了盖斯定律求焓变、化学平衡影响因素,平衡常数概念计算应用,注意平衡的条件分析是解题关键,题目难度中等.

 期末集结号系列答案
期末集结号系列答案| A. | 苏打不仅可用于治疗胃病,还可作灭火剂 | |
| B. | 用酸洗灼烧后的铂丝蘸取样品灼烧,火焰呈紫色,说明该样品中含钾元素 | |
| C. | 纯铁的熔点比生铁的低 | |
| D. | 日用铝制品表面覆盖着氧化膜,对内部金属起保护作用 |
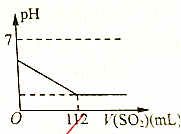 在标准状况下,向100mL新配制的氯水中通入SO2气体,SO2被氧化成硫酸,溶液的pH值变化如图所示,则原氯水的物质的量浓度为( )
在标准状况下,向100mL新配制的氯水中通入SO2气体,SO2被氧化成硫酸,溶液的pH值变化如图所示,则原氯水的物质的量浓度为( )| A. | 0.5mol/L | B. | 0.05mol/L | C. | 1mol/L | D. | 0.1mol/L |
| A. | 实验室通常用重结晶的方法分离提纯液体有机物 | |
| B. | 通过李比希燃烧法,可以确定有机物的结构 | |
| C. | 对有机物分子红外光谱图的研究有助于确定有机物分子中的官能团种类 | |
| D. | 核磁共振氢谱图中吸收峰的面积即为有机物中H原子的数目 |
| A. | 同分异构体 | B. | 同素异形体 | C. | 同位素 | D. | 同系物 |
| A. | 11种 | B. | 12种 | C. | 13种 | D. | 14种 |
| A. | 苯和乙烯都能使酸性KMnO4溶液褪色 | |
| B. | 乙烯可以用向下排空气法收集 | |
| C. | 乙烷、乙醇和乙酸都可以和钠反应生成氢气 | |
| D. | 苯是比水轻,有特殊气味的无色液体 |
 某化学课外小组用如图装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.
某化学课外小组用如图装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.