题目内容
4.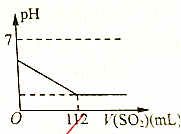 在标准状况下,向100mL新配制的氯水中通入SO2气体,SO2被氧化成硫酸,溶液的pH值变化如图所示,则原氯水的物质的量浓度为( )
在标准状况下,向100mL新配制的氯水中通入SO2气体,SO2被氧化成硫酸,溶液的pH值变化如图所示,则原氯水的物质的量浓度为( )| A. | 0.5mol/L | B. | 0.05mol/L | C. | 1mol/L | D. | 0.1mol/L |
分析 在标准状况下,向100mL新配制的氯水中通入SO2气体,SO2被氧化成硫酸,反应方程式为Cl2+SO2+2H2O=2HCl+2H2SO4,结合图象可知通入标准状况下112mL二氧化硫后溶液pH不再变化,则氯水中的氯气已经完全反应,先根据反应可计算出消耗氯气的物质的量,然后根据c=$\frac{n}{V}$计算出该氯水的物质的量浓度.
解答 解:根据图象曲线变化可知,通入标准状况下112mL二氧化硫后,溶液的pH不再变化,说明氯水中的氯气已经完全反应,
标准状况下112mL二氧化硫的物质的量为:$\frac{0.112L}{22.4L/mol}$=0.05mol,
根据反应Cl2+SO2+2H2O=2HCl+2H2SO4可知,该氯水中含有氯气的物质的量为:0.05mol×2=0.1mol,
所以该氯水的物质的量浓度为:$\frac{0.1mol}{0.1L}$=1mol/L,
故选C.
点评 本题考查了物质的量浓度的计算,题目难度中等,明确反应反应原理为解答关键,注意掌握物质的量浓度的概念及表达式,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
14.下列叙述I和叙述II均正确且有因果关系的是( )
| 选项 | 叙述I | 叙述II |
| A | H2有还原性,浓硫酸有强氧化性 | 不能用浓硫酸干燥H2 |
| B | CuS难溶于水和硫酸 | 反应:H2S+CuSO4=CuS↓+H2SO4 可以发生 |
| C | 海水中含有大量的Cl-、Br-等离子 | 向海水中通入F2可大量获得Cl2、Br2 |
| D | SO2具有酸性和漂白性 | 往紫色石蕊溶液中通入SO2,溶液先变红再褪色 |
| A. | A | B. | B | C. | C | D. | D |
15.根据陈述的知识,类推得出的结论正确的是( )
| A. | 磷在足量氧气中燃烧生成一种氧化物,则碳在足量氧气中燃烧也生成一种氧化物 | |
| B. | 稀硝酸能将木炭氧化成二氧化碳,同理稀硫酸也能将木炭氧化成二氧化碳 | |
| C. | CO2与SiO2化学式相似,则CO2与SiO2的物理性质也相似 | |
| D. | NaHCO3、(NH4)2CO3固体受热后均能生成气体,则Na2CO3固体受热后也能生成气体 |
12.能正确表示下列反应的离子方程式的是( )
| A. | (NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-═Fe(OH)2↓ | |
| B. | 向明矾溶液中滴加Ba(OH)2溶液,恰好使SO${\;}_{4}^{2-}$沉淀完全:2Al3++3SO${\;}_{4}^{2-}$+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ | |
| C. | AlCl3溶液中加入过量稀氨水:Al3++4NH3•H2O═AlO${\;}_{2}^{-}$+4NH${\;}_{4}^{+}$+2H2O | |
| D. | 向FeBr2溶液中通入足量氯气:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- |
10.已知1,3丁二烯( )可以发生1,2加成或者1,4加成,其1,4加成反应的原理是分子中的两个双键同时断裂,1,4号碳各加上一个原子后,中间两个碳的未成对电子又配对成双键.则有机物A(结构简式
)可以发生1,2加成或者1,4加成,其1,4加成反应的原理是分子中的两个双键同时断裂,1,4号碳各加上一个原子后,中间两个碳的未成对电子又配对成双键.则有机物A(结构简式  )与溴水反应的产物共有( )种.
)与溴水反应的产物共有( )种.
 )可以发生1,2加成或者1,4加成,其1,4加成反应的原理是分子中的两个双键同时断裂,1,4号碳各加上一个原子后,中间两个碳的未成对电子又配对成双键.则有机物A(结构简式
)可以发生1,2加成或者1,4加成,其1,4加成反应的原理是分子中的两个双键同时断裂,1,4号碳各加上一个原子后,中间两个碳的未成对电子又配对成双键.则有机物A(结构简式  )与溴水反应的产物共有( )种.
)与溴水反应的产物共有( )种.| A. | 5 | B. | 8 | C. | 9 | D. | 10 |
8.下列说法正确的是( )
| A. | CHCl2分子的立体构型为正四面体形 | |
| B. | H2O分子中氧原子的杂化轨道类型为sp2,分子的立体构型为V形 | |
| C. | CO2分子中碳原子的杂化轨道类型为sp,分子的立体构型为直线形 | |
| D. | NH4+的立体构型为三角锥形 |