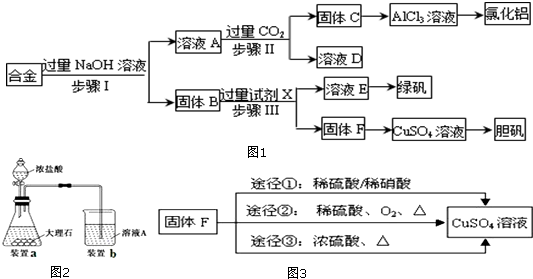
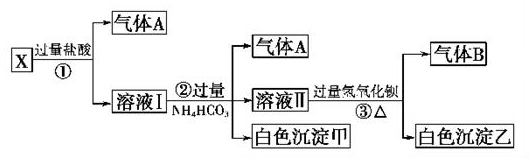
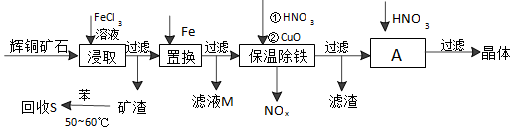
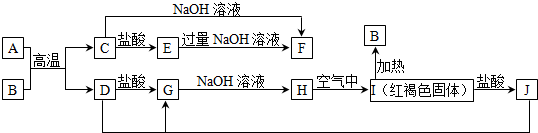
题目内容
1.美丽、芳香的鲜花,会给紧张而又忙碌的工作、学习、生活带来轻松和愉悦的心情.如果在花瓶中加入“鲜花保鲜剂”,就会延长鲜花的寿命.下表是1L“鲜花保鲜剂”的成分,请你阅读后回答下列问题:| 成分 | 质量(g) | 摩尔质量( mol•L -1) |
| 蔗糖 | 50.00 | 342 |
| 硫酸钾 | 0.50 | 174 |
| 阿司匹林 | 0.35 | 180 |
| 高锰酸钾 | 0.50 | 158 |
| 硝酸银 | 0.04 | 170 |
(2)“鲜花保鲜剂”中K+的物质的量浓度为(阿司匹林中不含K+):2×$\frac{0.50}{174}$+$\frac{0.50}{158}$mol•L -1(只要求写表达式,不需计算).
(3)配制上述lL“鲜花保鲜剂”所需的仪器有:托盘天平、烧杯、玻璃棒、药匙、1000 mL容量瓶 、胶头滴管 .(在横线上填写所缺仪器的名称).
(4)配制过程中,下列操作配制结果没有影响的是AD(填字母).
A.容量瓶在使用前未干燥,里面有少量蒸馏水
B.定容时仰视液面
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaC1溶液而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
(5)欲确定“鲜花保鲜剂”中硝酸银的浓度,可加入的试剂中含有Cl-(填化学符号)
分析 (1)依据C=$\frac{n}{V}$,溶液体积相等,则溶质物质的量越大溶液物质的量浓度越大;
(2)硫酸钾和高锰酸钾都含有钾离子,溶液中钾离子总的物质的量除以溶液体积为钾离子物质的量浓度;
(3)依据配制一定物质的浓度溶液一般步骤选项需要仪器:
(4)分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析;
(5)银离子能够与氯离子反应生成氯化银白色沉淀,据此检验银离子存在.
解答 解:(1)同一溶液,体积相等,则物质的量越大溶液浓度越大,
蔗糖的物质的量为:$\frac{50g}{342g/mol}$=0.146mol;
硫酸钾的物质的量为:$\frac{0.5mol}{174g/mol}$=0.00287mol;
阿司匹林的物质的量为:$\frac{0.35mol}{180/mol}$=0.00194mol;
高锰酸钾的物质的量:$\frac{0.50g}{158g/mol}$=0.0032mol;
硝酸银的物质的量:$\frac{0.04g}{170g/mol}$=0.00024mol;
所以蔗糖的物质的量最大,溶液中蔗糖的物质的量浓度最多;
故答案为:蔗糖;
(2)溶液中钾离子的物质的量为(2×$\frac{0.50}{174}$+$\frac{0.50}{158}$)mol,则依据C=$\frac{n}{V}$,V=1L,溶液中钾离子的物质的量浓度为=$\frac{n}{V}$=2×$\frac{0.50}{174}$+$\frac{0.50}{158}$;
故答案为:2×$\frac{0.50}{174}$+$\frac{0.50}{158}$;
(3)配制一定物质的浓度溶液一般步骤:计算、称量、溶解、移液、洗涤、定容等,用到的仪器:托盘天平、烧杯、玻璃棒、药匙、1000 mL容量瓶、胶头滴管;还缺少的仪器:1000 mL容量瓶、胶头滴管;
(4)A.容量瓶在使用前未干燥,里面有少量蒸馏水,对溶质的物质的量和溶液体积都不产生影响,溶液浓度不变,故A选;
B.定容时仰视液面,导致溶液体积偏大,溶液浓度偏小,故B不选;
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaCl溶液而未洗净,容量瓶中沾有氯化钠,氯化钠能够消耗银离子,导致溶液中银离子浓度偏小,故C不选;
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理,属于正确操作,溶液浓度准确,故D选;
故选:AD;
(5)银离子能够与氯离子反应生成氯化银白色沉淀,向待测液中加入少量氯化钠,若产生白色沉淀即可证明溶液中含有银离子;
故答案为:Cl-.
点评 本题考查学生配制一定物质的量浓度的溶液的知识,明确物质的量浓度概念是解题关键,题目难度不大,注意银离子检验方法.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 次氯酸钙溶液中通入过量的二氧化碳Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO | |
| B. | 硫酸亚铁溶液中加入过氧化氢溶液Fe2++2H2O2+4H+=Fe3++4H2O | |
| C. | 用氨水吸收少量二氧化硫OH-+SO2=HSO3- | |
| D. | 硝酸铁溶液加入过量氨水3NH3•H2O+Fe3+=Fe(OH)3↓+3NH4+ |

(1)步骤一:充分反应后,过滤除去CaSO4沉淀.设计一个简单的实验,检验产物葡萄糖酸溶液中是否含有SO42-:取少量溶液于试管中,滴加BaCl2溶液,若产生白色沉淀,则说明含有SO42-.反之,说明不含SO42-
(2)步骤二:将葡萄糖酸溶液与ZnO混合,使其充分反应后,继续加入葡萄糖酸溶液至pH为5.8,其目的是抑制Zn2+的水解 ,下列物质可替代ZnO的是b(填字母).
a.NH3•H2O b.Zn(OH)2 c.NaOH d.ZnSO4
(3)将最后所得溶液浓缩至原来体积的$\frac{1}{3}$,加入适量无水乙醇,放置8h以上,经结晶、分离、干燥获得葡萄糖酸锌晶体.分离过程中加入无水乙醇的目的是降低葡萄糖酸锌的溶解度,有利于其结晶析出.
(4)下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Cu2+ | 5.2 | 6.4 |
①取样,加入适量的KMnO4溶液,微热,调节溶液pH至3.2~5.2 (填写范围),除去溶液中Fe元素.
②加入过量的锌粉,过滤,向滤渣中加入适量稀硫酸,继续过滤,将两次滤液合并得较高纯度的硫酸锌溶液.
③将纯碱慢慢加入上述硫酸锌溶液中,得碱式碳酸锌[其化学式为Zn2(OH)2CO3],同时有无色气体产生.写出该反应的离子方程式:2CO32-+2Zn2++H2O=Zn2(OH)2CO3↓+CO2↑.
④过滤、洗涤,将沉淀灼烧得活性氧化锌.其中灼烧需要的主要仪器有:酒精灯、玻璃棒、三脚架、泥三角、坩埚、坩埚钳等.