题目内容
10.辉铜矿石主要含有硫化亚铜(Cu2S)及少量脉石(SiO2).一种以辉铜矿石为原料制备硝酸铜的工艺流程如下: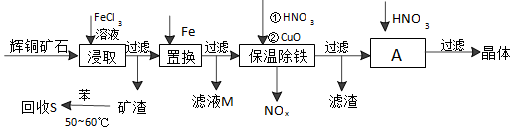
(1)写出浸取过程中Cu2S溶解的离子方程式Cu2S+4Fe3+=2Cu2++4Fe2++S.
(2)回收S过程中温度控制在50℃~60℃之间,不宜过高或过低的原因是温度高苯容易挥发、温度低溶解速率小.
(3)保温除铁过程中加入CuO的目的是调节溶液的pH,使铁元素(Fe3+)完全转化为Fe(OH)3沉淀.
(4)A步操作为蒸发浓缩、冷却结晶要用硝酸调节溶液的pH,其理由是抑制Cu2+的水解.
分析 辉铜矿加入氯化铁溶液溶解浸取过滤,得到矿渣加入苯水浴加热回收硫单质;加入在滤液中加入铁还原铁离子和铜离子过滤,滤液M中加入氯气氧化反应生成氯化铁循环使用,保温除铁加入稀硝酸溶液和氧化铜反应,调节溶液pH除去杂质离子,过滤得到滤液为硫酸亚铁溶液,在稀硝酸溶液中蒸发浓缩,冷却结晶过滤洗涤得到晶体;
(1)铁离子做氧化剂被还原为亚铁离子,Cu2S被氧化,生成铜离子和硫单质;
(2)苯易挥发,温度过低溶解速率小;
(3)Fe3++3H2O?Fe(OH)3+3H+,加入CuO使水解平衡正向进行,调节溶液的PH使铁元素完全转化为氢氧化铁沉淀;
(4)加热过程中Cu2+会水解,加入硝酸抑制Cu2+的水解,不引入新的杂质.
解答 解:(1)铁离子做氧化剂,Cu2S被氧化,离子方程式为Cu2S+4Fe3+=2Cu2++4Fe2++S,
故答案为:Cu2S+4Fe3+=2Cu2++4Fe2++S;
(2)苯沸点比较低,温度过高苯容易挥发,且温度过低溶解速率小,
故答案为:温度高苯容易挥发、温度低溶解速率小;
(3)保温除铁过程中加入CuO的目的是调节溶液的pH,使铁元素(Fe3+)完全转化为Fe(OH)3沉淀,
故答案为:调节溶液的pH,使铁元素(Fe3+)完全转化为Fe(OH)3沉淀;
(4)A步操作为蒸发浓缩、冷却结晶,要用硝酸调节溶液的pH,其理由是抑制Cu2+的水解,故答案为:蒸发浓缩、冷却结晶;抑制Cu2+的水解.
点评 本题考查物质的制备实验,为高考常见题型,把握制备流程及发生的反应为解答的关键,侧重于学生的分析能力和实验能力的考查,注意氧化还原反应、盐类水解的应用,题目难度不大.

练习册系列答案
相关题目
1.美丽、芳香的鲜花,会给紧张而又忙碌的工作、学习、生活带来轻松和愉悦的心情.如果在花瓶中加入“鲜花保鲜剂”,就会延长鲜花的寿命.下表是1L“鲜花保鲜剂”的成分,请你阅读后回答下列问题:
(1)“鲜花保鲜剂”中物质的量浓度最大的成分是蔗糖 .(填写名称).
(2)“鲜花保鲜剂”中K+的物质的量浓度为(阿司匹林中不含K+):2×$\frac{0.50}{174}$+$\frac{0.50}{158}$mol•L -1(只要求写表达式,不需计算).
(3)配制上述lL“鲜花保鲜剂”所需的仪器有:托盘天平、烧杯、玻璃棒、药匙、1000 mL容量瓶 、胶头滴管 .(在横线上填写所缺仪器的名称).
(4)配制过程中,下列操作配制结果没有影响的是AD(填字母).
A.容量瓶在使用前未干燥,里面有少量蒸馏水
B.定容时仰视液面
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaC1溶液而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
(5)欲确定“鲜花保鲜剂”中硝酸银的浓度,可加入的试剂中含有Cl-(填化学符号)
| 成分 | 质量(g) | 摩尔质量( mol•L -1) |
| 蔗糖 | 50.00 | 342 |
| 硫酸钾 | 0.50 | 174 |
| 阿司匹林 | 0.35 | 180 |
| 高锰酸钾 | 0.50 | 158 |
| 硝酸银 | 0.04 | 170 |
(2)“鲜花保鲜剂”中K+的物质的量浓度为(阿司匹林中不含K+):2×$\frac{0.50}{174}$+$\frac{0.50}{158}$mol•L -1(只要求写表达式,不需计算).
(3)配制上述lL“鲜花保鲜剂”所需的仪器有:托盘天平、烧杯、玻璃棒、药匙、1000 mL容量瓶 、胶头滴管 .(在横线上填写所缺仪器的名称).
(4)配制过程中,下列操作配制结果没有影响的是AD(填字母).
A.容量瓶在使用前未干燥,里面有少量蒸馏水
B.定容时仰视液面
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaC1溶液而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
(5)欲确定“鲜花保鲜剂”中硝酸银的浓度,可加入的试剂中含有Cl-(填化学符号)
5.某学生用托盘天平称取3.3g食盐,称量时指针若左偏,此时应该( )
| A. | 增加药品 | B. | 减少药品 | C. | 增加砝码 | D. | 减少砝码 |
15.下列实验操作完全正确的是( )
| 编号 | 实验 | 操作 |
| A | 用浓硫酸配制一定浓度的稀硫酸 | 准确量取浓硫酸,将浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中. |
| B | 除去BaSO4中的少量BaCO3 | 加入足量盐酸,充分反应后,过滤、洗涤、干燥 |
| C | 量取盐酸溶液 | 用25mL量筒量取4.0mol/L的盐酸5.62mL |
| D | 取出分液漏斗中所需的上层液体 | 下层液体从分液漏斗下端管口放出,关闭活塞,换一个接收容器,上层液体继续从分液漏斗下端管口放出 |
| A. | A | B. | B | C. | C | D. | D |
2.下列各组离子,在溶液中能大量共存、加入NaOH溶液后加热既有气体放出又有沉淀生成的一组是( )
| A. | Ba2+、NO3-、NH4+、Cl- | B. | K+、Ba2+、Cl-、SO42- | ||
| C. | Al3+、CO32-、NH4+、AlO2- | D. | Cu2+、NH4+、SO42-、K+ |
19.下列说法正确的是( )
| A. | 目前,工业上冶炼铝通常采用的方法是铝热反应法 | |
| B. | 铝能用于冶炼难熔的金属(如Cr、V、Mn等),这是因为铝具有还原性,在冶炼反应中放出大量的热量 | |
| C. | 由海水制备无水氯化镁,主要有以下步骤:①加熟石灰;②过滤;③加盐酸;④蒸发结晶;⑤在一定条件下脱水干燥 | |
| D. | 在冶金工业上,Na、Mg、Al、K、Ca、Zn 均不能用常用化学还原剂制得 |