题目内容
12.根据下式所示的氧化还原反应设计一个原电池:Cu+2Ag+═Cu2++2Ag(1)画出此原电池的装置简图,并注明原电池的正极和负极以及外电路中电子流向.(在装置图中标出)

(2)写出两个电极上的电极反应:
正极:Ag++e-=Ag
负极:Cu-2e-=Cu2+.
分析 根据电池反应式知,该反应中铜失电子发生氧化反应而作负极,银作正极,采用盐桥原电池,则铜电极对应的溶液为可溶性的铜盐溶液,银电极对应的溶液为可溶性的银盐溶液,一般用硝酸银溶液,电子从负极沿导线流向正极.
解答 解:(1)根据Cu(s)+2Ag+(aq)=Cu2+(aq)+2Ag(s)知,铜易失电子作负极,铜电极对应的电解质溶液为可溶性的铜盐溶液,如硝酸铜溶液,正极上银离子得电子发生还原反应,则银作正极,银电极对应的溶液为硝酸银溶液,所以该原电池为:
故答案为: ;
;
(2)铜易失电子作负极,银作正极,铜电极上铜失电子发生氧化反应,电极反应式为Cu-2e-=Cu2+,银电极上得电子发生还原反应,电极反应式为:Ag++e-=Ag,
故答案为:Ag++e-=Ag;Cu-2e-=Cu2+.
点评 本题考查了原电池的设计,根据电池反应式中得失电子来确定正负极材料及电解质溶液,明确元素化合价变化是解本题关键,原电池设计是新课标中要求学生掌握的内容,难度中等.

练习册系列答案
 小学教材全测系列答案
小学教材全测系列答案
相关题目
3.CO(g)+H2O(g)═H2(g)+CO2(g)△H<0,在其他条件不变的情况下( )
| A. | 加入催化剂,改变了反应的途径,反应的△H也随之改变 | |
| B. | 反应物总能量小于生成物总能量 | |
| C. | 若在原电池中进行,反应放出的热量不变 | |
| D. | 升高温度,反应速率加快,但反应的△H不变 |
7.有A、B、C、D、E五种常见化合物,都是由下表中的离子形成的:
为了鉴别上述化合物.分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,只有B为紫色(透过蓝色钴玻璃);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验填空:
(1)写出B、D的化学式:BKNO3,DCuSO4.
(2)将含1mol A的溶液与含1mol E的溶液反应后蒸干,仅得到一种化合物,该化合物的化学式为Na2CO3.
(3)在A溶液中加入少量澄清石灰水,其离子方程式为2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+2H2O.
(4)C常用作净水剂,用离子方程式表示其净水原理Al3++3H2O?Al(OH)3(胶体)+3H+.
| 阳离子 | K+ Na+ Cu2+Al3+ |
| 阴离子 | SO42-HCO3-NO3- OH- |
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,只有B为紫色(透过蓝色钴玻璃);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验填空:
(1)写出B、D的化学式:BKNO3,DCuSO4.
(2)将含1mol A的溶液与含1mol E的溶液反应后蒸干,仅得到一种化合物,该化合物的化学式为Na2CO3.
(3)在A溶液中加入少量澄清石灰水,其离子方程式为2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+2H2O.
(4)C常用作净水剂,用离子方程式表示其净水原理Al3++3H2O?Al(OH)3(胶体)+3H+.
4.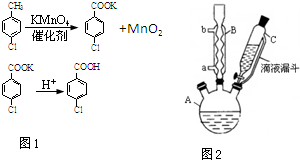 对氯苯甲酸是合成非甾族消炎镇痛药的中间体,还能用于燃料和农药的合成,实验室中制备对氯苯甲酸的反应(图1)、装置图如图2:
对氯苯甲酸是合成非甾族消炎镇痛药的中间体,还能用于燃料和农药的合成,实验室中制备对氯苯甲酸的反应(图1)、装置图如图2:
常温条件下的有关数据如下表所示:
实验步骤:在规格为250mL的装置A中加入一定量的催化剂、适量KMnO4、100mL水;安装好装置,在滴液漏斗中加入6.00mL对氯甲苯,在温度为93℃左右时,逐滴滴入对氯甲苯;控制温度在93℃左右,反应2h,过滤,将滤渣用热水洗涤,使洗涤液与滤液合并,加入稀硫酸酸化,加热浓缩;然后过滤,将滤渣用冷水进行洗涤,干燥后称量其质量为7.19g.
请回答下列问题:
(1)装置B的名称是球形冷凝管.
(2)量取6.00mL对氯甲苯应选用的仪器是C.
A.10mL量筒 B.50mL容量瓶 C.50mL酸式滴定管 D.50mL碱式滴定管
(3)控制温度为93℃左右的方法是水浴加热.对氯甲苯的加入方法是逐滴加入而不是一次性加入,原因是减少对氯甲苯的挥发,提高原料利用率.
(4)第一次过滤的目的是除去MnO2,滤液中加入稀硫酸酸化,可观察到的实验现象产生白色沉淀.
(5)第二次过滤所得滤渣要用冷水进行洗涤,其原因是可除去对氯苯甲酸表面的可溶性杂质且尽量减小对氯苯甲酸的损耗.
(6)本实验的产率是D(填标号).
A.60% B.70% C.80% D.90%
 对氯苯甲酸是合成非甾族消炎镇痛药的中间体,还能用于燃料和农药的合成,实验室中制备对氯苯甲酸的反应(图1)、装置图如图2:
对氯苯甲酸是合成非甾族消炎镇痛药的中间体,还能用于燃料和农药的合成,实验室中制备对氯苯甲酸的反应(图1)、装置图如图2:常温条件下的有关数据如下表所示:
| 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 颜色 | 水溶性 | |
| 对氯甲苯 | 7.5 | 162 | 1.07 | 无色 | 难溶 |
| 对氯苯甲酸 | 243 | 275 | 1.54 | 白色 | 微溶 |
| 对氯苯甲酸钾 | 具有盐的通性,属于可溶性盐 | ||||
请回答下列问题:
(1)装置B的名称是球形冷凝管.
(2)量取6.00mL对氯甲苯应选用的仪器是C.
A.10mL量筒 B.50mL容量瓶 C.50mL酸式滴定管 D.50mL碱式滴定管
(3)控制温度为93℃左右的方法是水浴加热.对氯甲苯的加入方法是逐滴加入而不是一次性加入,原因是减少对氯甲苯的挥发,提高原料利用率.
(4)第一次过滤的目的是除去MnO2,滤液中加入稀硫酸酸化,可观察到的实验现象产生白色沉淀.
(5)第二次过滤所得滤渣要用冷水进行洗涤,其原因是可除去对氯苯甲酸表面的可溶性杂质且尽量减小对氯苯甲酸的损耗.
(6)本实验的产率是D(填标号).
A.60% B.70% C.80% D.90%
1.美丽、芳香的鲜花,会给紧张而又忙碌的工作、学习、生活带来轻松和愉悦的心情.如果在花瓶中加入“鲜花保鲜剂”,就会延长鲜花的寿命.下表是1L“鲜花保鲜剂”的成分,请你阅读后回答下列问题:
(1)“鲜花保鲜剂”中物质的量浓度最大的成分是蔗糖 .(填写名称).
(2)“鲜花保鲜剂”中K+的物质的量浓度为(阿司匹林中不含K+):2×$\frac{0.50}{174}$+$\frac{0.50}{158}$mol•L -1(只要求写表达式,不需计算).
(3)配制上述lL“鲜花保鲜剂”所需的仪器有:托盘天平、烧杯、玻璃棒、药匙、1000 mL容量瓶 、胶头滴管 .(在横线上填写所缺仪器的名称).
(4)配制过程中,下列操作配制结果没有影响的是AD(填字母).
A.容量瓶在使用前未干燥,里面有少量蒸馏水
B.定容时仰视液面
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaC1溶液而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
(5)欲确定“鲜花保鲜剂”中硝酸银的浓度,可加入的试剂中含有Cl-(填化学符号)
| 成分 | 质量(g) | 摩尔质量( mol•L -1) |
| 蔗糖 | 50.00 | 342 |
| 硫酸钾 | 0.50 | 174 |
| 阿司匹林 | 0.35 | 180 |
| 高锰酸钾 | 0.50 | 158 |
| 硝酸银 | 0.04 | 170 |
(2)“鲜花保鲜剂”中K+的物质的量浓度为(阿司匹林中不含K+):2×$\frac{0.50}{174}$+$\frac{0.50}{158}$mol•L -1(只要求写表达式,不需计算).
(3)配制上述lL“鲜花保鲜剂”所需的仪器有:托盘天平、烧杯、玻璃棒、药匙、1000 mL容量瓶 、胶头滴管 .(在横线上填写所缺仪器的名称).
(4)配制过程中,下列操作配制结果没有影响的是AD(填字母).
A.容量瓶在使用前未干燥,里面有少量蒸馏水
B.定容时仰视液面
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaC1溶液而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
(5)欲确定“鲜花保鲜剂”中硝酸银的浓度,可加入的试剂中含有Cl-(填化学符号)
2.下列各组离子,在溶液中能大量共存、加入NaOH溶液后加热既有气体放出又有沉淀生成的一组是( )
| A. | Ba2+、NO3-、NH4+、Cl- | B. | K+、Ba2+、Cl-、SO42- | ||
| C. | Al3+、CO32-、NH4+、AlO2- | D. | Cu2+、NH4+、SO42-、K+ |