题目内容
11.图中A~J均为中学化学中常见的物质,它们之间有如下转化关系.其中A、D为金属单质.(反应过程中生成的水及其他产物已略去)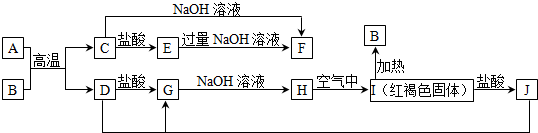
请回答以下问题:
(1)B的化学式为Fe2O3.
(2)写出A与B反应的化学方程式2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3.
(3)写出J与D反应转化为G的离子方程式2Fe3++Fe=3Fe2+.
(4)C和盐酸反应生成E,写出此反应的化学方程式Al2O3+6HCl=2AlCl3+3H2O.
分析 I为红褐色固体,则I为Fe(OH)3,加热分解生成B为Fe2O3,I与盐酸反应生成J,则J为FeCl3;D与J反应生成G,G与氢氧化钠反应生成H,H在空气中转化为氢氧化铁,则H为Fe(OH)2.A、D为金属单质,A与B的反应生成C与D,则C为金属氧化物,C能与氢氧化钠、盐酸反应,则C为Al2O3,故A为Al,D为Fe,则G为FeCl2,结合转化关系可知E为AlCl3,F为NaAlO2,据此进行解答.
解答 解:I为红褐色固体,则I为Fe(OH)3,加热分解生成B为Fe2O3,I与盐酸反应生成J,则J为FeCl3;D与J反应生成G,G与氢氧化钠反应生成H,H在空气中转化为氢氧化铁,则H为Fe(OH)2.A、D为金属单质,A与B的反应生成C与D,则C为金属氧化物,C能与氢氧化钠、盐酸反应,则C为Al2O3,故A为Al,D为Fe,则G为FeCl2,结合转化关系可知E为AlCl3,F为NaAlO2,
(1)通过以上分析知,B为Fe2O3,故答案为:Fe2O3;
(2)A为Al,B为氧化铁,铝与氧化铁在高温下发生铝热反应,反应的化学方程式为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,
故答案为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3;
(3)D为Fe,G为FeCl2,J与D反应转化为G的离子方程式为:2Fe3++Fe═3Fe2+,
故答案为:2Fe3++Fe═3Fe2+;
(4)C是氧化铝,氧化铝和稀盐酸反应生成氯化铝和水,反应方程式为Al2O3+6HCl=2AlCl3+3H2O,
故答案为:Al2O3+6HCl=2AlCl3+3H2O.
点评 本题考查无机物推断,难度中等,I为红褐色及C能与酸、碱反应等为突破口,侧重考查学生的推理能力及对与元素化合物的性质熟练掌握,试题培养了学生的分析、理解能力及逻辑推理能力

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案| 成分 | 质量(g) | 摩尔质量( mol•L -1) |
| 蔗糖 | 50.00 | 342 |
| 硫酸钾 | 0.50 | 174 |
| 阿司匹林 | 0.35 | 180 |
| 高锰酸钾 | 0.50 | 158 |
| 硝酸银 | 0.04 | 170 |
(2)“鲜花保鲜剂”中K+的物质的量浓度为(阿司匹林中不含K+):2×$\frac{0.50}{174}$+$\frac{0.50}{158}$mol•L -1(只要求写表达式,不需计算).
(3)配制上述lL“鲜花保鲜剂”所需的仪器有:托盘天平、烧杯、玻璃棒、药匙、1000 mL容量瓶 、胶头滴管 .(在横线上填写所缺仪器的名称).
(4)配制过程中,下列操作配制结果没有影响的是AD(填字母).
A.容量瓶在使用前未干燥,里面有少量蒸馏水
B.定容时仰视液面
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaC1溶液而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
(5)欲确定“鲜花保鲜剂”中硝酸银的浓度,可加入的试剂中含有Cl-(填化学符号)
| A. | Ba2+、NO3-、NH4+、Cl- | B. | K+、Ba2+、Cl-、SO42- | ||
| C. | Al3+、CO32-、NH4+、AlO2- | D. | Cu2+、NH4+、SO42-、K+ |
| A. | 目前,工业上冶炼铝通常采用的方法是铝热反应法 | |
| B. | 铝能用于冶炼难熔的金属(如Cr、V、Mn等),这是因为铝具有还原性,在冶炼反应中放出大量的热量 | |
| C. | 由海水制备无水氯化镁,主要有以下步骤:①加熟石灰;②过滤;③加盐酸;④蒸发结晶;⑤在一定条件下脱水干燥 | |
| D. | 在冶金工业上,Na、Mg、Al、K、Ca、Zn 均不能用常用化学还原剂制得 |
| A. | 0.1mol•L-1的NaOH溶液:K+、Na+、SO42-、CO32- | |
| B. | 甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl- | |
| C. | pH=1的溶液:K+、Na+、F-、Br- | |
| D. | Na2S溶液中:SO42-、K+、Cl-、Cu2+ |
| Ⅰ | Ⅱ | Ⅲ | Ⅳ | |
| 盐酸液的体积(mL) | 30 | 30 | 30 | 30 |
| 样品(g) | 3.32 | 4.15 | 5.81 | 7.47 |
| 二氧化碳的体积(mL) | 672 | 840 | 896 | 672 |
(2)另取3.32g天然碱样品于300℃加热分解至完全(300℃时Na2CO3不分解),产生CO2112mL(标准状况)和水0.45g,计算并确定该天然碱的化学式.
(3)已知Na2CO3和HCl(aq)的反应分下列两步进行:
Na2CO3+HCl→NaCl+NaHCO3 Na2CO3+HCl→NaCl+CO2↑+H2O
由上表中第Ⅳ组数据可以确定所用的HCl(aq)的浓度为2.5mol/L.
(4)依据表所列数据以及天然碱的化学式,讨论并确定上述实验中CO2(标准状况)体积V(mL)与样品质量W(g)之间的关系式.

