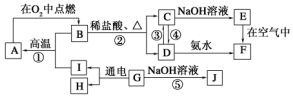
题目内容
20.下列根据实验操作和现象所得出的结论正确的是( )| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向某溶液中滴入少量盐酸,然后滴入少量的氯化钡溶液 | 先无明显现象,后有白色沉淀. | 说明原溶液中含有SO42- |
| B | 向某氯化亚铁溶液中滴入少量氯水,然后滴入少量的KSCN溶液 | 溶液变成血红色 | 说明原氯化亚铁已氧化变质 |
| C | 加热分解某盐X,将产生的气体通入硝酸酸化的BaCl2溶液 | 实验开始立即产生白色沉淀 | X可能是NaHCO3 |
| D | 向溶液X中滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH4+ |
| A. | A | B. | B | C. | C | D. | D |
分析 A.加入盐酸排除干扰,然后加入氯化钡溶液若生成白色沉淀,可证明原溶液中含有硫酸根离子;
B.证明氯化亚铁变质,应该直接用硫氰化钾溶液检验,不需要加入氯水;
C.二氧化碳不与氯化钡溶液反应,不可能生成沉淀;
D.氨气极易溶于水,检验铵根离子必须用浓氢氧化钠溶液并加热.
解答 解:A.某溶液中滴入少量盐酸,排除了干扰离子,然后滴入少量的氯化钡溶液,若先无明显现象,后有白色沉淀,可证明原溶液中含有SO42-,故A正确;
B.某氯化亚铁溶液中滴入少量氯水,亚铁离子被氧化成铁离子,干扰了检验结果,应该直接滴入少量的KSCN溶液检验原氯化亚铁是否氧化变质,故B错误;
C.NaHCO3加热分解生成二氧化碳气体,二氧化碳不与BaCl2溶液反应,则不会生成白色沉淀,故C错误;
D.向溶液X中滴加稀NaOH溶液,由于氨气极易溶于水,该方法无法检验铵根离子,应该用浓氢氧化钠溶液加热来检验NH4+,故D错误;
故选A.
点评 本题考查了化学实验方案的评价,题目难度不大,明确常见元素及其 化合物性质为解答关键,注意熟练掌握常见离子的性质及检验方法,试题培养了学生的分析能力及化学实验能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.下列变化中,前者是物理变化,后者是化学变化,且都有明显颜色变化的是( )
| A. | 用冰水混合物冷却SO3气体;加热I2 | |
| B. | 木炭吸附NO2气体;将Cl2通入品红溶液中 | |
| C. | 打开盛有NO的集气瓶;冷却NO2气体 | |
| D. | 向品红溶液中通入SO2,向FeCl3溶液滴加KSCN溶液 |
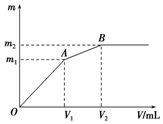
8. 硝酸越稀还原产物中氮元素的化合价越低.某同学取铁铝合金与足量很稀的硝酸充分反应没有气体放出.在反应后的溶液中逐滴加入4mol•L-1 NaOH溶液,所加NaOH溶液的体积与产生的沉淀的物质的量的关系如图.下列说法不正确的是( )
硝酸越稀还原产物中氮元素的化合价越低.某同学取铁铝合金与足量很稀的硝酸充分反应没有气体放出.在反应后的溶液中逐滴加入4mol•L-1 NaOH溶液,所加NaOH溶液的体积与产生的沉淀的物质的量的关系如图.下列说法不正确的是( )
 硝酸越稀还原产物中氮元素的化合价越低.某同学取铁铝合金与足量很稀的硝酸充分反应没有气体放出.在反应后的溶液中逐滴加入4mol•L-1 NaOH溶液,所加NaOH溶液的体积与产生的沉淀的物质的量的关系如图.下列说法不正确的是( )
硝酸越稀还原产物中氮元素的化合价越低.某同学取铁铝合金与足量很稀的硝酸充分反应没有气体放出.在反应后的溶液中逐滴加入4mol•L-1 NaOH溶液,所加NaOH溶液的体积与产生的沉淀的物质的量的关系如图.下列说法不正确的是( )| A. | D点溶液中存在:c(NH4+)+c(Na+)+c(H+)=c(OH-)+c(NO3-) | |
| B. | EF段发生化学反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O | |
| C. | 原溶液中n(NH4+)=0.012mol | |
| D. | 溶液中结合OH-能力最强的离子是H+,最弱的离子是Al3+ |
5.下列有关物质性质及其应用的说法,正确的是( )
| A. | 碳酸钠溶液呈碱性,可用热的纯碱溶液除去矿物油污 | |
| B. | 氧化铝的熔点很高,可用于制作耐高温材料 | |
| C. | C12、SO2均有漂白性,可使紫色石蕊溶液褪色 | |
| D. | 钠的金属性强于钾,工业上可用钠制取钾Na+KCl$\frac{\underline{\;850℃\;}}{\;}$K↑+NaCl |
9.分子式为C8H10的芳香烃,其可能的结构有( )
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
10.如图是某有机物结构的球棍模型,下列有关叙述正确的是( )
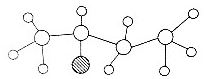

| A. | 该有机物肯定是的含烃氧衍生物 | |
| B. | 该有机物能发生取代反应和加成反应 | |
| C. | 该有机物可能是C4H9Cl | |
| D. | 该有机物可能与CH3CH2OCH2CH2互为同分异构体 |
 向含0.02mol Al3+的明矾溶液中逐滴加入0.2mol/L的Ba(OH)2溶液时,测得产生沉淀的质量m和逐滴加入Ba(OH)2溶液的体积V的关系如图所示.计算出A、B点分别对应的m、V,填 在下面的横线上.
向含0.02mol Al3+的明矾溶液中逐滴加入0.2mol/L的Ba(OH)2溶液时,测得产生沉淀的质量m和逐滴加入Ba(OH)2溶液的体积V的关系如图所示.计算出A、B点分别对应的m、V,填 在下面的横线上.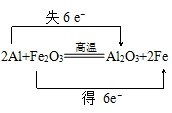 .
.