题目内容
12.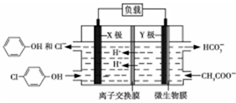 测得某工业废水中含有乙酸钠及对氯酚(
测得某工业废水中含有乙酸钠及对氯酚(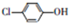 ),为改善水质现利用微生物电池加以去除,反应原理如图所示,下列说法正确的是( )
),为改善水质现利用微生物电池加以去除,反应原理如图所示,下列说法正确的是( )| A. | X极为微生物电池的负极 | |
| B. | 该电池能够在高温下工作 | |
| C. | 图中离子交换膜应为阴离子交换膜 | |
| D. | Y极电极反应式为:CH3COO--8e-+4H2O═2HCO3-+9H+ |
分析 原电池中阳离子移向正极,根据原电池中氢离子的移动方向可知X为正极,正极有氢离子参与反应,电极反应式为Cl- -OH+2e-+H+═
-OH+2e-+H+═ -OH+Cl-,电流从正极经导线流向负极,以此解答该题.
-OH+Cl-,电流从正极经导线流向负极,以此解答该题.
解答 解:A.原电池中阳离子移向正极,所以X是正极,故A错误;
B.高温下碳酸氢盐和苯酚不稳定,所以在低温下反应,故B错误;
C.离子交换膜只允许氢离子通过所以是阳离子交换膜,故C错误;
D.Y极是负极,发生氧化反应,电极反应式为CH3COO--8e-+4H2O═2HCO3-+9H+,故D正确;
故选D.
点评 本题涉及原电池的工作原理以及应用的考查,为高频考点,侧重于学生的分析能力的考查,注意知识的迁移和应用是解题的关键,难度中等,注意把握原电池和电解池中离子的移动方向.

练习册系列答案
相关题目
3.一定条件下,在体积为10L的恒容密闭容器中,发生如下反应:2X(g)+Y(g)?Z(g),经60s达到平衡,生成0.3mol Z,下列说法正确的是( )
| A. | 用Y 表示的化学反应速率为0.005 mol/(L•s) | |
| B. | 将容器体积变为20 L,Z的平衡浓度变为原来的$\frac{1}{2}$ | |
| C. | 若升高温度Y的转化率减小,则正反应为放热反应 | |
| D. | 达到平衡时,Y与Z的浓度相等 |
20.下列说法中正确的是( )
| A. | 同周期元素的原子电子层数相同 | |
| B. | (长式)元素周期表是按相对原子质量逐渐增大的顺序从左到右排列的 | |
| C. | 最外层电子数相同的元素都是同一族的元素 | |
| D. | 同一主族元素的原子最外层电子数一定相同 |
7.氯化硼的熔点为-107℃,沸点为12.5℃,在其分子中键与键之间的夹角为120o,它能水解,有关叙述正确的是( )
| A. | 氯化硼液态时能导电而固态时不导电 | |
| B. | 硼原子以sp杂化 | |
| C. | 氯化硼晶体为分子晶体 | |
| D. | 氯化硼是极性分子 |
4.下列关于物质性质的比较,不正确的是( )
| A. | 金属性强弱:Na>Mg>Al | B. | 热稳定性:Na2CO3>NaHCO3 | ||
| C. | 碱性强弱:KOH>NaOH>LiOH | D. | 酸性强弱:HIO4>HBrO4>HClO4 |
1.某化学实验室产生的废液中含有Fe3+、Cu2+、Zn2+、Cl-四种离子,现设计下列方案对废液进行处理,以回收金属并制备较纯净的氯化锌、氯化铁晶体.
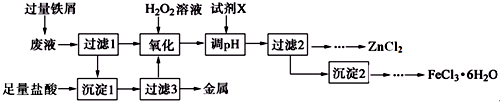
(1)氧化过程中加入H2O2发生反应的离子方程式为2Fe2++H2O2+2H+═2Fe3++2H2O,加入H2O2后立即有大量气泡生成,可能的原因是溶液中金属阳离子催化H2O2分解.
(2)Fe3+水解的平衡常数表达式为Kh=$\frac{{c}^{3}({H}^{+})}{c(F{e}^{3+})}$,加入试剂X调pH合适范围为[3.7,5.4),X可以是下列试剂中的AD(填字母).
A.ZnCO3 B.NH3•H2O C.ZnCl2 D.ZnO
(3)由沉淀2获得FeCl3•6H2O晶体的操作为①加入过量盐酸溶解;②蒸发浓缩、冷却结晶;③过滤、洗涤、干燥.

| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀pH | 2.7 | 7.6 | 5.2 | 5.4 |
| 完全沉淀pH | 3.7 | 9.6 | 6.9 | 7.8 |
(2)Fe3+水解的平衡常数表达式为Kh=$\frac{{c}^{3}({H}^{+})}{c(F{e}^{3+})}$,加入试剂X调pH合适范围为[3.7,5.4),X可以是下列试剂中的AD(填字母).
A.ZnCO3 B.NH3•H2O C.ZnCl2 D.ZnO
(3)由沉淀2获得FeCl3•6H2O晶体的操作为①加入过量盐酸溶解;②蒸发浓缩、冷却结晶;③过滤、洗涤、干燥.
2.下列有关金属钠的说法不正确的是( )
| A. | 钠具有银白色金属光泽,在空气中易变质,生成过氧化钠 | |
| B. | 钠应保存在煤油中 | |
| C. | 钠的化学性质很活泼,在自然界不能以游离态存在 | |
| D. | 钠和钾的合金在室温呈液态,可做原子反应堆的导热剂 |
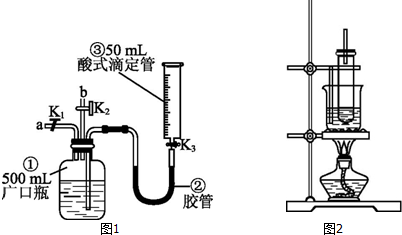
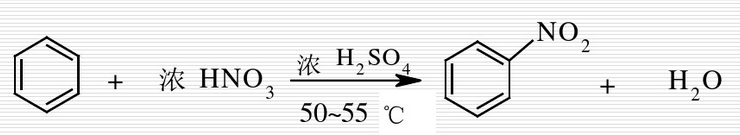 ;
;