题目内容
升高温度反应速度加快的主要原因是( )
| A、活化分子的百分数增加 |
| B、活化能增加 |
| C、单位体积内分子总数增加 |
| D、分子运动速度加快 |
考点:化学反应速率的影响因素
专题:化学反应速率专题
分析:升高温度能加快反应速率的主要原因是活化分子的百分数增加,以此解答该题.
解答:
解:升高温度增大活化分子百分数,活化分子数目增大,分子之间的有效碰撞增大,化学反应速率加快.
故选A.
故选A.
点评:本题考查化学能对反应速率的影响,为高频考点,侧重学生的分析能力的考查,题目难度不大,本题注意相关知识的积累.

练习册系列答案
相关题目
化学式为C5H7Cl的有机物,其结构不可能是( )
A、只含1个 键的直链有机物 键的直链有机物 |
B、含2个 键的直链有机物 键的直链有机物 |
C、含1个 键的环状有机物 键的环状有机物 |
| D、含1个-C≡C-键的直链有机物 |
T℃时,A气体与B气体反应生成C气体.反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是( )
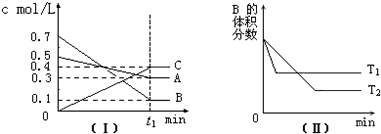

| A、在 t1时间内用B表示该反应的平均速率为0.4/t1mol?L-1?min-1 |
| B、在(t1+10)min时,保持其他条件不变,增大压强,平衡向逆反应方向移动 |
| C、T℃时,在相同容器中,若由0.3mol?L-1A、0.1 mol?L-1 B和0.4 mol?L-1 C反应,达到平衡后,C的浓度仍为0.4 mol?L-1 |
| D、其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大 |
在相同温度和压强下,将32g硫分别在纯氧气中和空气中完全燃烧,令前者放出的热量为Q1,后者放出的热量为Q2,则关于Q1和Q2的相对大小判断正确的是( )
| A、Q1<Q2 |
| B、Q1>Q2 |
| C、Q1=Q2 |
| D、无法确定 |
接触法制硫酸时,煅烧黄铁矿产生的气体混合物中各成分的最佳体积分数分别为:N282%,O211%,S027%.若该混合气体经接触室发生反应后,气体体积变为原来的96.7%.若设反应前后的压强和温度不变,则消耗O2的体积分数为( )
| A、7.7% | B、6.6% |
| C、5.5% | D、3.3% |