题目内容
4.FeCl3是一种很重要的铁盐,主要用于污水处理,且有效果好、价格便宜等优点.工业上可将铁粉溶于盐酸中,先生成FeCl2,再通入Cl2氧化来制备FeCl3溶液.已知:①标准状况下,1体积水中最多能溶解500体积的HCl;②饱和NaCl溶液的浓度约为5.00mol•L-1.
(1)在标准状况下,将44.8LHCl气体溶于100mL水中,所得溶液A的密度为1.038g•cm-3,则溶液中HCl的物质的量浓度为12mol/L;(若使饱和NaCl溶液中Cl-浓度与溶液A中的Cl-浓度相等,则还应溶解约156.8L标准状况HCl气体(溶液体积变化忽略不计).
(2)若实验室需0.5mol•L-1NaCl溶液240mL,则应量取体积是25mL的饱和NaCl溶液来配制,在配制过程
中,使用前必须检查是否漏液的仪器有容量瓶;下列配制操作,造溶液浓度偏高的是CE(选填标号).
A.量取溶液时有少量液体溅出
B.容量瓶用蒸馏水洗涤干净后未干燥
C.定容时,俯视液面加水至刻度线
D.转移液体后,未用蒸馏水洗涤烧杯和玻璃棒
E.用量筒量取溶液时仰视读数
F.定容时不慎超过度线,立即用胶头滴管吸出多余部分
(3)FeCl3溶液可以用来净水,其净水的原理为FeCl3+3H2O?Fe(OH)3(胶体)+3HCl(用离子方程式表示),若100mL、1mol•L-1的FeCl3溶液净水时,生成具有净水作用的微粒数小于0.1NA(填“大于”、“等于”或“小于”).
分析 (1)根据n=$\frac{V}{{V}_{m}}$计算HCl的物质的量,根据m=nM计算HCl的质量,根据V=$\frac{m}{ρ}$计算出溶液的体积,再根据c=$\frac{n}{V}$计算溶液中HCl的物质的量浓度;饱和NaCl溶液的浓度约为5.00mol•L-1,根据两者的浓度差计算需溶解的氯化氢的量;
(2)配制溶液240mL需要选择250mL容量瓶,利用n=c浓V浓=c稀V稀来计算;能用来盛放液体,且有活塞的仪器使用时必须检查是否漏水;配制一定物质的量浓度的溶液过程中,能引起误差的原因主要有:称量不准确、转移不完全、读数不符合要求、操作不规范等,可以根据错误操作对c=$\frac{n}{v}$=$\frac{m}{\frac{M}{v}}$的影响进行判断;
(3)FeCl3水解生成Fe(OH)3胶体,胶体具有吸附性而净水;水解反应为可逆反应.
解答 解:(1)标况下,44.8L HCl的物质的量n=$\frac{m}{M}$=$\frac{44.8L}{22.4L/mol}$=2mol,HCl的质量=2mol×36.5g/mol=73g,100mL水的质量约为100g,则所得溶液的质量为173g,所得溶液的体积为:V=$\frac{m}{ρ}$=$\frac{173}{1.038}$mL,所得溶液的物质的量浓度为c=$\frac{n}{V}$=$\frac{2mol}{\frac{173}{1.038}mL}$=12mol/L,饱和NaCl溶液的浓度约为5.00mol•L-1,需再溶解的氯化氢的量为(12-5)mol/L×22.4L/mol=156.8L,
故答案为:12mol/L;156.8;
(2)配制溶液240mL需要选择250mL容量瓶,稀溶液为0.5mol•L-1NaCl溶液,饱和NaCl溶液的浓度约为5.00mol•L-1,n=c浓V浓=c稀V稀,V浓=$\frac{250×0.5}{5}$=25mL,容量瓶能用来盛放液体,且有活塞,使用时必须检查是否漏水,
A.量取溶液时有少量液体溅出,导致配制的溶液中溶质的物质的量减小,配制的溶液浓度偏低,故A错误;
B.容量瓶用蒸馏水洗涤干净后未干燥,对溶质的物质的量和溶液的体积都不会产生影响,对配制溶液的浓度无影响,故B错误;
C.定容时,俯视液面加水至刻度线,导致溶液的体积偏小,溶液的浓度偏高,故C正确;
D.转移液体后,未用蒸馏水洗涤烧杯和玻璃棒,导致配制的溶液中溶质的物质的量减小,配制的溶液浓度偏低,故D错误;
E.用量筒量取溶液时仰视读数,导致配制的溶液中溶质的物质的量偏大,配制的溶液浓度偏高,故E正确;
F.定容时不慎超过度线,立即用胶头滴管吸出多余部分,导致配制的溶液中溶质的物质的量减小,配制的溶液浓度偏低,故F错误;
故答案为:25;容量瓶;CE;
(3)FeCl3水解生成Fe(OH)3胶体,水解方程式为FeCl3+3H2O═Fe(OH)3(胶体)+3HCl Na2CO3+H2O=NaHCO3+NaOH,胶体能吸附水中的悬浮物而净水,因为水解为可逆反应,且生成胶体为微观粒子的集合体,则生成具有净水作用的微粒数小于0.1NA,
故答案为:FeCl3+3H2O═Fe(OH)3(胶体)+3HCl;小于.
点评 本题考查溶液的配制及有关物质的量浓度的计算,选择容量瓶的规格是解答本题的易错点,熟练应用物质的量浓度的相关计算公式等为解答的关键,侧重分析与计算能力的考查,题目难度中等.

 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案| A. | 食用加碘盐可预防碘缺乏症,加碘盐中加的含碘物质是碘单质 | |
| B. | 因为NaCl的水溶液能导电,所以NaCl溶液属于强电解质 | |
| C. | 电解熔融NaCl得到23.0g金属钠时能产生22.4 L氯气(标准状况下) | |
| D. | 37Cl 是氯元素的一种同位素,23Na37Cl中质子数和中子数之比是7:8 |
| A. | 一定温度、压强下,一定数量的任何物质的体积由微粒间的平均距离所决定 | |
| B. | 碱性氧化物一定是金属氧化物,金属氧化物不一定是碱性氧化物 | |
| C. | 根据化合物中含氢数目的多少,把化合物分为一元酸、二元酸、三元酸等 | |
| D. | 强电解质溶液的导电能力一定强于弱电解质溶液的导电能力 |
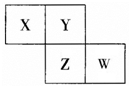 X、Y、Z、W均为短周期元素,它们在元素周期表中相对位置如图所示,已知W原子的最外层电子数比内层电子数少3 个,下列说法正确的是( )
X、Y、Z、W均为短周期元素,它们在元素周期表中相对位置如图所示,已知W原子的最外层电子数比内层电子数少3 个,下列说法正确的是( )| A. | 氧化物对应水化物酸性W比Z强 | |
| B. | Y单质与Z的氢化物水溶液反应,有沉淀生成 | |
| C. | X单质氧化性强于Y单质 | |
| D. | 简单离子的半径:Z<W |
 某课外小组分别用如图所示装置对原电池和电解原理进行实验探究.请回答:
某课外小组分别用如图所示装置对原电池和电解原理进行实验探究.请回答: 亚硝酸(HNO2)是一元弱酸,亚硝酸及其盐在实验和工业生产中有重要应用.请回答:
亚硝酸(HNO2)是一元弱酸,亚硝酸及其盐在实验和工业生产中有重要应用.请回答:
