题目内容
9.下列说法正确的是( )| A. | 一定温度、压强下,一定数量的任何物质的体积由微粒间的平均距离所决定 | |
| B. | 碱性氧化物一定是金属氧化物,金属氧化物不一定是碱性氧化物 | |
| C. | 根据化合物中含氢数目的多少,把化合物分为一元酸、二元酸、三元酸等 | |
| D. | 强电解质溶液的导电能力一定强于弱电解质溶液的导电能力 |
分析 A.物质的体积由微粒间的平均距离、微粒的大小以及微粒的数目决定;
B.碱性氧化物一定为金属氧化物,而金属氧化物不一定为碱性氧化物,如过氧化钠不属于碱性氧化物;
C.一元酸、二元酸是根据酸电离出氢离子的个数进行分类的;
D.溶液的导电能力与离子浓度成正比,与电解质的强弱无关.
解答 解:A.影响物质体积大小的因素:微粒间的平均距离、微粒的大小以及微粒的数目,其中影响固体液体体积大小的主要因素是微粒的大小,影响气体体积大小的主要因素是微粒间距,故A错误;
B.碱性氧化物对应的水化物为碱,所以碱性氧化物一定是金属氧化物,而金属氧化物不一定是碱性氧化物,如过氧化钠为金属氧化物,但是过氧化钠不属于碱性氧化物,故B正确;
C.一元酸、二元酸是根溶液的导电能力与离子浓度成正比,与电解质的强弱无关,故C错误;
D.据酸电离出氢离子的个数进行分类的,如CH3COOH含有4个H,但为一元酸,故D错误;
故选B.
点评 本题考查物质分类、电解质的强弱与导电能力的关系、物质体积的判断等解答该类概念性题目,应对概念十分清晰.抓住概念中的关键词,是解答的关键,题目难度不大.

练习册系列答案
 特高级教师点拨系列答案
特高级教师点拨系列答案
相关题目
19.下列观点,正确的是( )
| A. | 化学研究会造成严重的环境污染,危害人们的生活 | |
| B. | 乙醇和汽油都是可再生能源,应大力推广“乙醇汽油” | |
| C. | 用大量木材作燃料可以缓解当前能源不足问题 | |
| D. | 对于常见的大多数金属,其金属活动性越强,冶炼就越困难 |
20. 在一固定容积的密闭容器中,进行如下反应:CO+H2O(g)?CO2+H2.其化学平衡常数K与温度T的关系如表:
在一固定容积的密闭容器中,进行如下反应:CO+H2O(g)?CO2+H2.其化学平衡常数K与温度T的关系如表:
回答下列问题:
(1)该反应的正反应为放(填“吸”或“放”)热反应.
(2)判断该反应到达平衡的依据是BCF(填字母代号)
A.容器内压强不变 B.混合气体中[CO]不变
C.V正(H2)=V逆(H2O) D.[CO]=[CO2]
E.K值不变 F.[CO]/[H2O]不变
(3)若容器的体积固定为10L,在容器中通入一定量的CO和H2O(g),并在T1℃时发生反应.
①CO和H2O的浓度变化如图所示,则在0-4min内正反应的平均反应速率为v(CO)0.03mol•L-1•min-1.
②此反应的温度等于850℃(填“大于”,“小于”或“等于”).
③图中6-7min浓度发生变化的原因可能是BE
A.只充入H2O(g) B.只升高温度
C.只使用催化剂 D.只充入惰性气体
E.只充入CO2
(4)850℃时,起始浓度[CO]=a mol/L,[H2O]=b mol/L,平衡时[H2]=c mol/L.则:
①a、b、c之间的关系是c2=(a-c)(b-c)或c=$\frac{ab}{a+b}$.
②当a=b时,a=2c.
 在一固定容积的密闭容器中,进行如下反应:CO+H2O(g)?CO2+H2.其化学平衡常数K与温度T的关系如表:
在一固定容积的密闭容器中,进行如下反应:CO+H2O(g)?CO2+H2.其化学平衡常数K与温度T的关系如表:| T(℃) | 700 | 800 | 850 | 1000 | 1200 |
| K | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
(1)该反应的正反应为放(填“吸”或“放”)热反应.
(2)判断该反应到达平衡的依据是BCF(填字母代号)
A.容器内压强不变 B.混合气体中[CO]不变
C.V正(H2)=V逆(H2O) D.[CO]=[CO2]
E.K值不变 F.[CO]/[H2O]不变
(3)若容器的体积固定为10L,在容器中通入一定量的CO和H2O(g),并在T1℃时发生反应.
①CO和H2O的浓度变化如图所示,则在0-4min内正反应的平均反应速率为v(CO)0.03mol•L-1•min-1.
②此反应的温度等于850℃(填“大于”,“小于”或“等于”).
③图中6-7min浓度发生变化的原因可能是BE
A.只充入H2O(g) B.只升高温度
C.只使用催化剂 D.只充入惰性气体
E.只充入CO2
(4)850℃时,起始浓度[CO]=a mol/L,[H2O]=b mol/L,平衡时[H2]=c mol/L.则:
①a、b、c之间的关系是c2=(a-c)(b-c)或c=$\frac{ab}{a+b}$.
②当a=b时,a=2c.
14.下列离子方程式与所述事实相符且正确的是( )
| A. | 向FeBr2溶液中通入过量的Cl2:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| B. | 用食醋除去水壶内的水垢:CaCO3+2H+═Ca2++CO2↑+H2O | |
| C. | KHCO3与足量澄清石灰水反应:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| D. | 在强碱性溶液中,次氯酸钠将Mn2+氧化成MnO2:Mn2++ClO-+H2O═MnO2↓+Cl-+2H+ |
1. 某学生用0.100 0mol/L的NaOH标准溶液滴定未知浓度的盐酸,其操作可分为如下几步:
某学生用0.100 0mol/L的NaOH标准溶液滴定未知浓度的盐酸,其操作可分为如下几步:
A.量取25.00mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞;
B.用标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液;
D.取标准NaOH溶液注入碱式滴定管至刻度线0以上2cm~3cm;
E.调节液面至“0”或“0”以下刻度并记下读数;
F.把锥形瓶放在滴定管的下面,用标准NaOH溶液滴定至终点并记滴定管液面的刻度.
据此实验完成填空:
(1)正确操作步骤的顺序是B、D、C、E、A、F(用序号字母填写).
(2)上述B步骤操作的目的是防止滴定管内壁附着的水将标准溶液稀释而带来误差.
(3)上述A步骤操作之前,先用待测溶液润洗锥形瓶,则对滴定结果的影响是偏高.
(4)判断到达滴定终点的实验现象是滴入最后一滴NaOH溶液,溶液由无色变为浅红色,且在半分钟内不褪色.
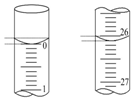
(5)若滴定开始和结束时,酸式滴定管中的液面如图所示:则起始读数为0.00mL,终点读数为26.10mL.
(6)某学生根据三次实验分别记录有关数据如上:请选用其中合理的数据列式计算该盐酸溶液的物质的量浓度:c(HCl)=0.1044mol/L.
 某学生用0.100 0mol/L的NaOH标准溶液滴定未知浓度的盐酸,其操作可分为如下几步:
某学生用0.100 0mol/L的NaOH标准溶液滴定未知浓度的盐酸,其操作可分为如下几步:A.量取25.00mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞;
B.用标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液;
D.取标准NaOH溶液注入碱式滴定管至刻度线0以上2cm~3cm;
E.调节液面至“0”或“0”以下刻度并记下读数;
F.把锥形瓶放在滴定管的下面,用标准NaOH溶液滴定至终点并记滴定管液面的刻度.
据此实验完成填空:
(1)正确操作步骤的顺序是B、D、C、E、A、F(用序号字母填写).
(2)上述B步骤操作的目的是防止滴定管内壁附着的水将标准溶液稀释而带来误差.
(3)上述A步骤操作之前,先用待测溶液润洗锥形瓶,则对滴定结果的影响是偏高.
| 滴定 次数 | 盐酸溶液/mL | 0.100 0mol•L-1NaOH的体积(mL) | ||
| 滴定前 | 滴定 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
(5)若滴定开始和结束时,酸式滴定管中的液面如图所示:则起始读数为0.00mL,终点读数为26.10mL.
(6)某学生根据三次实验分别记录有关数据如上:请选用其中合理的数据列式计算该盐酸溶液的物质的量浓度:c(HCl)=0.1044mol/L.



 .
. .
. 有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有
有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有 最合理的方案.
最合理的方案.