题目内容
19.有关如下反应的叙述正确的是( )Ⅰ:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.0kJ/mol
Ⅱ:CO(g)+H2O(g)?CO2(g)+H2(g)△H=-43kJ/mol
Ⅲ:CaO(s)+CO2(g)?CaCO3(s)△H=-178.3kJ/mol
Ⅳ:C(s)+2H2O(g)+CaO(s)?CaCO3(s)+2H2(g)△H=akJ/mol.
| A. | a=+90.3 | |
| B. | 恒温恒压下,在已达平衡的反应I体系中再充入少量He时平衡正向移动 | |
| C. | 其他条件不变,加压对反应Ⅱ的反应速率无影响 | |
| D. | 其他条件不变,升高温度可提高反应Ⅲ中CO2的转化率 |
分析 A、根据盖斯定律:Ⅳ:C(s)+2H2O(g)+CaO(s)?CaCO3(s)+2H2(g)△H=Ⅰ+Ⅱ+Ⅲ,由此分析解答;
B、恒温恒压下,充入少量He时体积变大,相当于减小压强;
C、增大压强对反应Ⅱ的正逆反应加快;
D、升高平衡逆向移动,所以二氧化碳的转化率减少.
解答 解:A、△H=a=Ⅰ+Ⅱ+Ⅲ=131+(-43)+(-178.3)=-90.3,故A错误;
B、恒温恒压下,充入少量He时体积变大,相当于减小压强,所以平衡正向移动,故B正确;
C、增大压强对反应Ⅱ的正逆反应加快,所以加压对反应Ⅱ的反应速率有影响,而不是无影响,故C错误;
D、升高平衡逆向移动,所以二氧化碳的转化率减少,而不是提高转化率,故D错误;
故选B.
点评 本题考查反应速率的影响因素和化学平衡的移动,为考试高频考点,难度不大,B选在恒温恒压下,充入少量He,相当于减小压强.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.下列关于有机化合物说法正确的是( )
| A. | C3H6Cl2有4种同分异构体 | |
| B. | 1,4-二甲基苯也称为间二甲苯 | |
| C. | 乙烯使溴水和高锰酸钾溶液褪色的原理相同 | |
| D. | 煤的干馏和石油的分馏均为物理变化 |
11.常温下,下列有关说法正确的是( )
| A. | 0.1 mol•L-1的Na2S溶液:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| B. | pH=11的氨水与pH=3的硫酸各1L混合后,c(NH4+)>2c(SO42-) | |
| C. | pH=11的氨水与pH=11的醋酸钠溶液,由水电离出的c(H+)相等 | |
| D. | pH相同的①NaHCO3溶液②CH3COONa溶液中的c(Na+):①>② |
7.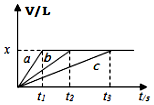 将等物质的量钠、镁、铝三种金属分别与200mL1mol•L-1的盐酸反应,测得生成的气体的体积V(已折合成标准状况的体积)与时间t的关系如图所示.下列说法正确的是( )
将等物质的量钠、镁、铝三种金属分别与200mL1mol•L-1的盐酸反应,测得生成的气体的体积V(已折合成标准状况的体积)与时间t的关系如图所示.下列说法正确的是( )
 将等物质的量钠、镁、铝三种金属分别与200mL1mol•L-1的盐酸反应,测得生成的气体的体积V(已折合成标准状况的体积)与时间t的关系如图所示.下列说法正确的是( )
将等物质的量钠、镁、铝三种金属分别与200mL1mol•L-1的盐酸反应,测得生成的气体的体积V(已折合成标准状况的体积)与时间t的关系如图所示.下列说法正确的是( )| A. | x=44.8 | B. | 反应后的镁和铝均有剩余 | ||
| C. | 金属的物质的量可能均为0.1mol | D. | 曲线c表示钠与盐酸的反应 |
 ,用化学方程式表示出它作供氧剂的原理:2CaO2+2H2O=2Ca(OH)2+O2↑.
,用化学方程式表示出它作供氧剂的原理:2CaO2+2H2O=2Ca(OH)2+O2↑.
 NO2是形成雾霾天气的原因之一.
NO2是形成雾霾天气的原因之一.
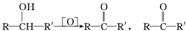 不易被氧化成羧酸
不易被氧化成羧酸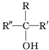 不易被氧化成醛或酮
不易被氧化成醛或酮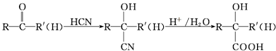
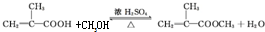 .
.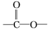 ”结构的共有6种.
”结构的共有6种.