题目内容
下列有关电解质溶液的说法正确的是( )
| A、蒸馏水中逐渐加入NaOH(s)的过程中KW不变 |
| B、CaCO3难溶于稀硫酸,更难溶于醋酸 |
| C、在Na2CO3稀溶液中,c(H+)+c(Na+)=c(OH-)+2c(CO32-)+c(HCO3-) |
| D、NaCl溶液和BaCl2溶液中水的KW不同 |
考点:电解质与非电解质
专题:电离平衡与溶液的pH专题
分析:A.NaOH固体溶解过程放热,KW只与温度有关;
B.硫酸钙微溶与水,醋酸钙易溶于水;
C.依据溶液中电荷守恒规律解答;
D.水的KW只受温度的影响.
B.硫酸钙微溶与水,醋酸钙易溶于水;
C.依据溶液中电荷守恒规律解答;
D.水的KW只受温度的影响.
解答:
解:A.NaOH固体溶解过程放热,温度升高,KW增大,故A错误;
B.硫酸钙微溶与水,醋酸钙易溶于水,所以CaCO3难溶于稀硫酸,但是易溶于醋酸,与醋酸反应生成醋酸钙和二氧化碳和水,故B错误;
C.Na2CO3稀溶液呈电中性,所以阳离子带的正电荷总数等于阴离子带的负电荷总数,c(H+)+c(Na+)=c(OH-)+2c(CO32-)+c(HCO3-),故C正确;
D.水的KW只受温度的影响,所以NaCl溶液和BaCl2溶液中水的KW相同,故D错误;
故选:C.
B.硫酸钙微溶与水,醋酸钙易溶于水,所以CaCO3难溶于稀硫酸,但是易溶于醋酸,与醋酸反应生成醋酸钙和二氧化碳和水,故B错误;
C.Na2CO3稀溶液呈电中性,所以阳离子带的正电荷总数等于阴离子带的负电荷总数,c(H+)+c(Na+)=c(OH-)+2c(CO32-)+c(HCO3-),故C正确;
D.水的KW只受温度的影响,所以NaCl溶液和BaCl2溶液中水的KW相同,故D错误;
故选:C.
点评:本题考查了弱电解质的电离,离子反应发生的条件,盐溶液中存在的电荷守恒规律,题目难度不大,电解质在水溶液中的行为是高考的热门考点,注意把握电解质电离的规律,以及电离平衡移动的影响因素.

练习册系列答案
相关题目
下列说法正确的是( )
| A、在蒸馏水中滴加浓H2SO4,KW不变 |
| B、CaCO3难溶于稀硫酸,也难溶于醋酸 |
| C、KClO3和SO3溶于水后能导电,故KClO3和SO3为电解质 |
| D、HCl溶液的导电性不一定强于CH3COOH溶液的导电性 |
 常温下,向100mL 0.01mol?L-1 MOH溶液中逐滴加入0.02mo1?L-1 HA溶液,图中所示曲线表示混合溶液的pOH变化情况(溶液体积变化忽略不计),溶液中pOH=-lg(OH-).下列说法中,不正确的是( )
常温下,向100mL 0.01mol?L-1 MOH溶液中逐滴加入0.02mo1?L-1 HA溶液,图中所示曲线表示混合溶液的pOH变化情况(溶液体积变化忽略不计),溶液中pOH=-lg(OH-).下列说法中,不正确的是( )| A、HA为一元弱酸 |
| B、MOH为一元强碱 |
| C、N点水的电离程度大于K点水的电离程度 |
| D、K点对应的溶液的pOH=10,则有c(HA)+c(H+)-c(OH-)=0.01mol?L-1 |
下列叙述正确的是( )
| A、汽油、柴油和植物油都是烃 |
| B、油脂、淀粉和蛋白质均可发生水解反应 |
| C、乙烯和苯使溴水褪色都是发生加成反应 |
| D、苯环含有碳碳单键和碳碳双键 |
 钢铁防腐方法有许多种,如图是其中的一种方法,描述正确的是( )
钢铁防腐方法有许多种,如图是其中的一种方法,描述正确的是( )| A、如图所示是牺牲阳极的阴极保护法 |
| B、铁闸门作阴极,发生还原反应 |
| C、电子流向:a→铁闸门,辅助电极→b |
| D、辅助电极上的反应:O2+2H2O+4e=4OH- |
实验是化学研究的基础,下列关于各实验装置的叙述正确的是( )
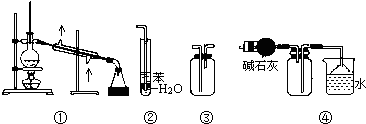
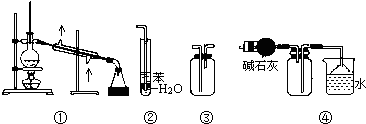
| A、装置①常用于分离互相溶解且沸点相差10℃以上的液态混合物 |
| B、装置②可用于吸收NH3或HCl气体,并防止到吸 |
| C、装置③可用于收集H2、CO2、Cl2、NH3等气体 |
| D、装置④可用于干燥、收集氨气,若将碱石灰改成五氧化二磷,可用于干燥、收集氯化氢 |
部分弱酸的电离平衡常数如下表:
下列选项正确的是( )
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数 (25℃) |
Ka=1.77×10-4 | Ka=4.9×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
| A、2CN-+H2O+CO2═2HCN+CO32- |
| B、中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者 |
| C、物质的量浓度相等的HCOONa和KCN溶液中,c(Na+)-c(HCOO-)<c(K+)-c(CN-) |
| D、c(NH4+)相等的HCOONH4溶液、NH4CN溶液、NH4HCO3溶液中,c(NH4HCO3)>c(NH4CN)>c(HCOONH4) |
下列说法正确的是( )
| A、水的离子积KW只与温度有关,但外加酸、碱、盐一定会影响水的电离程度 | ||||
| B、Ksp不仅与难溶电解质的性质和温度有关,还与溶液中相关离子的浓度有关 | ||||
C、常温下,在0.10mol?L-1的NH3?H2O溶液中加入少量NH4C1晶体,能使溶液的pH减小,
| ||||
| D、室温下,CH3COOH的Kα=1.7×10-5,NH3?H2O的Kb=1.7×10-5,CH3COOH溶液中的c (H+)与NH3?H2O中的c(OH-)相等 |