题目内容
1.如图所示是在实验室进行氨气快速制备与性质实验的组合装置,部分固定装置未画出.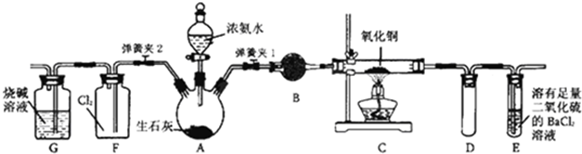
(1)在组装好装置后,若要检验A-E装置的气密性,其操作是先关闭弹簧夹2和分液漏斗活塞,打开弹簧夹1,向E中加水至浸没长导管末端,然后微热A,察到E中有气泡冒出,移开酒精灯,E中导管有水柱形成说明装置气密性良好.
(2)请用平衡移动的原理解释A中制取氨气的原理固体生石灰溶于浓氨水后,吸水,放出大量的热促使NH3挥发,溶液中OH-浓度增加,都促使NH3+H2O?NH3•H2O?NH4++OH-向生成NH3移动,加快氨气逸出.
(3)装置B中盛放试剂是碱石灰.
(4)关闭弹簧夹2,打开弹簧夹1,从分液漏斗放出浓氨水至浸没烧瓶中固体后关闭分液漏斗活塞,点燃C处酒精灯,装置C中黑色固体逐渐变红,装置E中有气泡冒出并产生白色沉淀(答现象);从E中逸出液面的气体可以直接排入空气,请写出在C中发生反应的化学方程式2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2↑+3H2O.
(5)当C中固体全部变红色后,关闭弹簧夹1,慢慢移开酒精灯,待冷却后,称量C中固体质量.若反应前固体质量为16g,反应后称重固体质量减少2.4g.通过计算确定该固体产物的成分是Cu2O、Cu.
(6)在关闭弹簧夹1后,打开弹簧夹2,残余气体进入F中,很快发现装置F中产生白烟,同时发现G中溶液迅速倒吸流入F中.写出产生白烟的化学方程式3Cl2+8NH3=N2+6NH4Cl.迅速产生倒吸的原因是盛满氯气的集气瓶中因氨气消耗氯气生成部分固体,导致内压减小,引起溶液倒吸.
分析 (1)组装好装置后,若要检验A-E装置的气密性,其操作是:首先关闭弹簧夹2和分液漏斗活塞,打开弹簧夹1,在E中装入水后,然后微热A,观察到E中有气泡冒出,移开酒精灯或松开双手,E中导管有水柱形成说明装置气密性良好;
(2)根据装置图可知,A中将浓氨水滴入到生石灰中,固体生石灰溶于浓氨水后,吸水,放出大量的热促使NH3挥发,同时溶液中存在平衡NH3+H2O?NH3•H2O?NH4++OH-,OH-浓度增加,平衡向生成NH3移动,据此答题;
(3)进入C中硬质试管的氨气应干燥,装置B的作用是干燥氨气,干燥氨气用碱石灰;
(4)反应后的尾气中含有未反应的氨气,氨气在E溶液中与二氧化硫反应生成亚硫酸铵,亚硫酸铵与氯化钡反应生成亚硫酸钡;
装置C中黑色固体逐渐变红,说明有Cu生成,从E中逸出液面的气体可以直接排入空气,说明氨气被氧化为氮气,同时生成水;
(5)生成的红色物质可能为Cu2O、Cu或二者混合物,反应前固体质量为16g,反应后称重固体质量减少2.4g,剩余固体质量为16g-2.4g=13.6g,计算剩余固体中Cu、氧元素质量确定组成,进而计算n(Cu):n(O)确定组成;
(6)氯气有强氧化性,氧化氨气生成N2,产生白烟,说明生成固体,故还生成NH4Cl;盛满氯气的集气瓶中因氨气消耗氯气生成部分固体,导致内压减小,引起溶液倒吸.
解答 解:(1)组装好装置后,若要检验A-E装置的气密性,其操作是:首先关闭弹簧夹2和分液漏斗活塞,打开弹簧夹1,在E中装入水后,然后微热A,观察到E中有气泡冒出,移开酒精灯或松开双手,E中导管有水柱形成说明装置气密性良好,
故答案为:关闭弹簧夹2和分液漏斗活塞,打开弹簧夹1,向E中加水至浸没长导管末端;
(2)根据装置图可知,A中将浓氨水滴入到生石灰中,固体生石灰溶于浓氨水后,吸水,放出大量的热促使NH3挥发,溶液中OH-浓度增加,都促使NH3+H2O?NH3•H2O?NH4++OH-向生成NH3移动,加快氨气逸出,
故答案为:固体生石灰溶于浓氨水后,吸水,放出大量的热促使NH3挥发,溶液中OH-浓度增加,都促使NH3+H2O?NH3•H2O?NH4++OH-向生成NH3移动,加快氨气逸出;
(3)进入C中硬质试管的氨气应干燥,装置B的作用是干燥氨气,干燥氨气用碱石灰,
故答案为:碱石灰;
(4)反应后的尾气中含有未反应的氨气,氨气在E溶液中与二氧化硫反应生成亚硫酸铵,亚硫酸铵与氯化钡反应生成亚硫酸钡,故还有白色沉淀沉淀,所以现象为有气泡冒出并产生白色沉淀,装置C中黑色固体逐渐变红,说明有Cu生成,从E中逸出液面的气体可以直接排入空气,说明氨气被氧化为氮气,同时生成水,C中发生反应的化学方程式为:2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2↑+3H2O,
故答案为:有气泡冒出并产生白色沉淀;2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2↑+3H2O;
(5)16gCuO中含有Cu元素质量为16g×$\frac{64}{80}$=12.8g,含有氧元素质量为16g-12.8g=3.2g,反应后称重固体质量减少2.4g,剩余固体质量为16g-2.4g=13.6g,大于12.8g,故剩余固体含有Cu、O元素,故n(Cu)=$\frac{12.8g}{64g/mol}$=0.2mol,含有O元素的质量为13.6g-12.8g=0.8g,n(O)=$\frac{0.8g}{16g/mol}$=0.05mol,n(Cu):n(O)=0.2mol:0.05mol=4:1>2:1,故剩余固体为Cu2O、Cu,
故答案为:Cu2O、Cu;
(6)氯气有强氧化性,氧化氨气生成N2,产生白烟,说明生成固体,故还生成NH4Cl,反应方程式为:3Cl2+8NH3=N2+6NH4Cl.盛满氯气的集气瓶中因氨气消耗氯气生成部分固体,导致内压减小,引起溶液倒吸,
故答案为:3Cl2+8NH3=N2+6NH4Cl;盛满氯气的集气瓶中因氨气消耗氯气生成部分固体,导致内压减小,引起溶液倒吸.
点评 本题考查氨气的制备与性质实验、对装置的理解、实验操作、化学计算等,难度中等,掌握物质的性质理解原理是解题的关键,是对知识的综合考查,需要学生具有扎实的基础与分析问题、解决问题的能力.

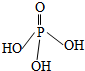 三聚磷酸可视为三个磷酸分子(磷酸结构式如图)之间脱去两个水分子的产物,三聚磷酸钠(俗称“五钠”)是常用的水处理剂.下列说法错误的是( )
三聚磷酸可视为三个磷酸分子(磷酸结构式如图)之间脱去两个水分子的产物,三聚磷酸钠(俗称“五钠”)是常用的水处理剂.下列说法错误的是( )| A. | 三聚磷酸中P的化合价为+5 | |
| B. | 三聚磷酸钠的化学式为Na5P3O10 | |
| C. | 以磷酸钠为原料通过化合反应也能生成三聚磷酸钠 | |
| D. | 多聚磷酸的结构可表示为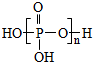 |
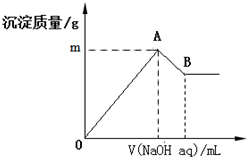 在含有0.06mol Cl-、0.07mol SO42-及一定量Mg2+和Al3+的混合溶液中,滴入2mol/L NaOH溶液,产生沉淀情况如图.若反应前Al3+的物质的量为a mol,Al3+的物质的量与混合溶液中离子总物质的量的比值为x(不考虑Mg2+和Al3+水解及水的电离).则下列说法错误的是( )
在含有0.06mol Cl-、0.07mol SO42-及一定量Mg2+和Al3+的混合溶液中,滴入2mol/L NaOH溶液,产生沉淀情况如图.若反应前Al3+的物质的量为a mol,Al3+的物质的量与混合溶液中离子总物质的量的比值为x(不考虑Mg2+和Al3+水解及水的电离).则下列说法错误的是( )| A. | a的取值范围是0<a<$\frac{1}{15}$ | |
| B. | 图中m的取值范围5.2~5.8 | |
| C. | A、B两点横坐标的数值均随x变化而变化 | |
| D. | 若B点横坐标数值为120,则a=0.04 |
| A. | 40mL | B. | 72mL | C. | 80mL | D. | 128mL |
| A. | 硫酸盐都易溶于水 | |
| B. | 检验红砖中的红色物质是否是Fe2O3的操作步骤为:样品-→粉碎-→加水溶解-→过滤-→向滤液中滴加KSCN溶液 | |
| C. | 分别还原a mol Fe2O3所需H2、Al、CO物质的量之比为3:2:3 | |
| D. | 明矾含有结晶水,是混合物 |
| A. | 钠在实验室通常保存在煤油中,可推知锂也可保存在煤油中 | |
| B. | FeCl2与Cl2反应生成FeCl3,可推知FeBr2也可与Br2反应生成FeBr3 | |
| C. | 工业制Mg采用电解MgCl2的方法,可推知工业制Al也采用电解AlCl3的方法 | |
| D. | CO2通入Ba(NO3)2溶液中无明显现象,可推知SO2通入Ba(NO3)2溶液中也无明显现象 |
已知:相关物质的溶解度(20℃)AgCl:1.5×10-4g Ag2SO4:0.796g
(1)甲同学的实验如表:
| 序号 | 操作 | 现象 |
| 实验Ⅰ | 将2mL 1mol/L AgNO3 溶液加入到1mL 1mol/L FeSO4溶液中 | 产生白色沉淀,随后有黑色固体产生 |
| 取上层清液,滴加KSCN 溶液 | 溶液变红 |
①白色沉淀的化学式是Ag2SO4.
②甲同学得出Ag+氧化了Fe2+的依据是有黑色固体(Ag )生成,加入KSCN 溶液后变红.
(2)乙同学为探究Ag+和Fe2+反应的程度,进行实验Ⅱ.
a.按如图连接装置并加入药品(盐桥中的物质不参与反应),发现电压表指针偏移.偏移的方向表明:电子由石墨经导线流向银.放置一段时间后,指针偏移减小.

b.随后向甲烧杯中逐渐加入浓Fe2(SO4)3溶液,发现电压表指针的变化依次为:偏移减小→回到零点→逆向偏移.
①a 中甲烧杯里的电极反应式是Fe2+-e-=Fe3+.
②b中电压表指针逆向偏移后,银为负 极(填“正”或“负”).
③由实验得出Ag+和Fe2+反应的离子方程式是Fe2++Ag+?Fe3++Ag.
(3)为进一步验证乙同学的结论,丙同学又进行了如表实验:
| 序号 | 操作 | 现象 |
| 实验Ⅲ | 将2mL 2mol/L Fe(NO3)3溶液加入有银镜的试管中 | 银镜消失 |
| 实验Ⅳ | 将2mL1mol/L Fe2(SO4)3溶液加入有银镜的试管中 | 银镜减少,未消失 |
| 实验Ⅴ | 将2mL 2mol/L FeCl3溶液加入有银镜的试管中 | 银镜消失 |
②用化学反应原理解释实验Ⅳ与Ⅴ的现象有所不同的原因:溶液中存在平衡:Fe3++Ag?Fe2++Ag+,且 AgCl比Ag2SO4溶解度更小,Cl-比SO42-更有利于降低Ag+ 浓度,所以实验Ⅴ比实验Ⅳ正向进行的程度更大.
(1)已知:N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ•mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534.0kJ•mol-1
2NO2(g)?N2O4(g)△H=-52.7kJ•mol-1
试写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式:2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-1083.0kJ•mol-1.
(2)工业上可用次氯酸钠与过量的氨反应制备肼,该反应的化学方程式为:NaClO+2NH3=N2H4+NaCl+H2O.
(3)一定条件下,在2L密闭容器中起始投入2mol NH3和4mol O2发生反应:
4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H<0
测得平衡时数据如下:
| 平衡时物质的量(mol) | n(NO) | n(H2O) |
| 温度T1 | 1.6 | 2.4 |
| 温度T2 | 1.2 | 1.8 |
②温度T1和T2的大小关系是T1<T2(填“>”、“<”或“=”).
(4)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2.某种电化学装置可实现如下转化:2CO2═2CO+O2,CO可用作燃料.已知该反应的阳极反应为:4OH--4e-═O2↑+2H2O,则阴极反应为2CO2+4e-+2H2O=2CO+4OH-.有人提出,可以设计反应2CO═2C+O2(△H>0)来消除CO的污染.请你判断上述反应是否能自发进行并说明理由不能,因为该反应的△H>0,△S<O.
(5)图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH溶液为电解液.
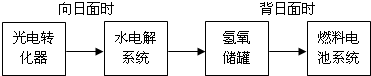
如果某段时间内氢氧储罐中共收集到33.6L气体(已折算成标准状况),则该段时间内水电解系统中转移电子的物质的量为2mol.