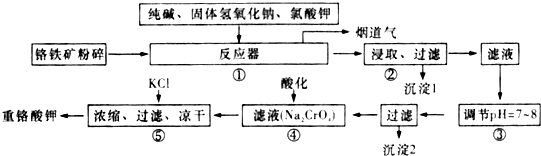
题目内容
16.为了测定铁铜合金的组成,将7.6g铁、铜合金加入100mL某浓度的稀硝酸中,待合金完全溶解后,共收集到NO气体2.24L(标准状况下),并测得溶液中H+的浓度为0.5mol•L-1.若反应前后溶液的体积变化忽略不计,则下列判断正确的是( )| A. | 上述反应中金属共失去电子0.1 mol | |
| B. | 合金中,铜的质量为2.8 g | |
| C. | 原硝酸的浓度:c(HNO3)=4.5 mol•L-1 | |
| D. | 要使溶液中的金属离子完全沉淀,需加5 mol•L-1的NaOH溶液60 mL |
分析 n(NO)=$\frac{2.24L}{22.4L/mol}$=0.1mol,则转移电子为0.1mol×(5-2)=0.3mol,反应后溶液中的c(H+)=0.5mol/L,则反应后剩余n(HNO3)=0.5mol/L×0.1L=0.05mol,设合金中Cu为xmol,Fe为ymol,由电子守恒可知:2x+3y=0.3mol,由合金的质量可知:64x+56y=7.6,解得x=0.075mol,y=0.05mol,结合选项分析.
解答 解:n(NO)=$\frac{2.24L}{22.4L/mol}$=0.1mol,则转移电子为0.1mol×(5-2)=0.3mol,反应后溶液中的c(H+)=0.5mol/L,则反应后剩余n(HNO3)=0.5mol/L×0.1L=0.05mol,设合金中Cu为xmol,Fe为ymol,由电子守恒可知:2x+3y=0.3mol,由合金的质量可知:64x+56y=7.6,解得x=0.075mol,y=0.05mol,
A.由分析可知,金属共失去电子0.3 mol,故A错误;
B.合金中,铜的质量为0.075mol×64=4.8 g,故B错误;
C.反应生成Cu(NO3)2、Fe(NO3)3和NO,以及剩余的硝酸,根据氮原子守恒可知,n(HNO3)=0.075×2+0.05×3+0.1+0.05=0.45mol,则c(HNO3)=$\frac{n}{V}$=$\frac{0.45mol}{0.1L}$=4.5mol/L,故C正确;
D.要使溶液中的金属离子完全沉淀,溶液中的溶质为NaNO3,n(NaNO3)=n(NaOH)=0.075×2+0.05×3+0.05=0.35mol,V=$\frac{n}{c}$=$\frac{0.35mol}{5mol/L}$=0.07L=70mL,故D错误.
故选C.
点评 本题主要考查混合物有关计算,涉及铁铜与硝酸反应、生成的盐与氢氧化钠反应,侧重于学生的得失电子守恒、质量守恒等综合运用和解决复杂问题的能力的考查,是一道考查能力的好题,难度中等.

| A. | 钠在实验室通常保存在煤油中,可推知锂也可保存在煤油中 | |
| B. | FeCl2与Cl2反应生成FeCl3,可推知FeBr2也可与Br2反应生成FeBr3 | |
| C. | 工业制Mg采用电解MgCl2的方法,可推知工业制Al也采用电解AlCl3的方法 | |
| D. | CO2通入Ba(NO3)2溶液中无明显现象,可推知SO2通入Ba(NO3)2溶液中也无明显现象 |
| A. | 船舶防腐时,船体上加装的阳极锌需定期更换 | |
| B. | 合成氨反应中使用高效催化剂可提高原料转化率 | |
| C. | 将图中的活塞快速推至A处固定,气体颜色先变深、再变浅,但比起始时深 | |
| D. | 等体积、等浓度NaOH溶液和CH3COOH溶液混合后溶液pH=7 |
(1)已知:N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ•mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534.0kJ•mol-1
2NO2(g)?N2O4(g)△H=-52.7kJ•mol-1
试写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式:2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-1083.0kJ•mol-1.
(2)工业上可用次氯酸钠与过量的氨反应制备肼,该反应的化学方程式为:NaClO+2NH3=N2H4+NaCl+H2O.
(3)一定条件下,在2L密闭容器中起始投入2mol NH3和4mol O2发生反应:
4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H<0
测得平衡时数据如下:
| 平衡时物质的量(mol) | n(NO) | n(H2O) |
| 温度T1 | 1.6 | 2.4 |
| 温度T2 | 1.2 | 1.8 |
②温度T1和T2的大小关系是T1<T2(填“>”、“<”或“=”).
(4)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2.某种电化学装置可实现如下转化:2CO2═2CO+O2,CO可用作燃料.已知该反应的阳极反应为:4OH--4e-═O2↑+2H2O,则阴极反应为2CO2+4e-+2H2O=2CO+4OH-.有人提出,可以设计反应2CO═2C+O2(△H>0)来消除CO的污染.请你判断上述反应是否能自发进行并说明理由不能,因为该反应的△H>0,△S<O.
(5)图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH溶液为电解液.
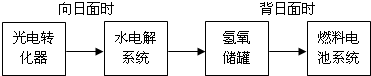
如果某段时间内氢氧储罐中共收集到33.6L气体(已折算成标准状况),则该段时间内水电解系统中转移电子的物质的量为2mol.
①非金属氧化物一定不是碱性氧化物
②金属氧化物一定是碱性氧化物
③电解质的电离需要通电
④Fe(OH)3、FeCl2、CaSiO3 都能直接用化合反应制备
⑤SO2能使酸性高锰酸钾溶液褪色,所以它具有漂白性
⑥SO2可形成酸雨,酸雨的PH小于5.6.
| A. | ①②④ | B. | ②⑤⑥ | C. | ①④⑥ | D. | 全部 |
①Na+、OH-、SO42-
②H+、Cl-、SO42-
③Na+、K+、OH-
④Na+、K+、NO3-.
| A. | ②③④ | B. | ②①④ | C. | ②③① | D. | ②①③ |
| A. | 不慎把浓硫酸沾在手上,立即用干布拭去,再用水冲洗 | |
| B. | 少量金属钠应保存在煤油中 | |
| C. | 氢氟酸、浓硝酸、氯水存放在带橡皮塞的棕色玻璃瓶中 | |
| D. | 漂白粉应密封保存 |
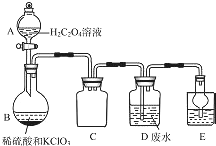 ClO2是一种国际上公认的安全无毒的绿色水处理剂.回答下列问题:
ClO2是一种国际上公认的安全无毒的绿色水处理剂.回答下列问题: