题目内容
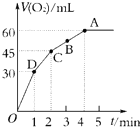 加入0.1mol MnO2粉末于50mL过氧化氢溶液(H2O2,ρ=1.1g?mL-1)中,在标准状况下放出气体的体积和时间的关系如图所示.
加入0.1mol MnO2粉末于50mL过氧化氢溶液(H2O2,ρ=1.1g?mL-1)中,在标准状况下放出气体的体积和时间的关系如图所示.(1)实验时放出气体的总体积是
(2)反应放出气体体积为气体总体积一半时所需时间为
(3)反应放出气体体积为气体总体积的
| 3 |
| 4 |
(4)A、B、C、D各点反应速率大小的顺序为
(5)解释反应速率变化的原因
考点:反应速率的定量表示方法
专题:化学反应速率专题
分析:(1)反应方程式为:2H2O2
2H2O+O2↑,该反应为不可逆反应,在4min后,收集到的气体体积不再增加,说明过氧化氢完全分解,根据图象可知生成的氧气的体积;
(2)反应放出气体体积为气体总体积一半为30mL,根据图象判断需要的时间;
(3)反应放出气体体积为气体总体积的
时,生成的气体体积为45mL,根据图象判断反应时间;
(4)根据浓度对反应速率的影响判断A、B、C、D各点反应速率大小;
(5)随着反应的进行,溶液的浓度逐渐降低,反应速率逐渐减小.
| ||
(2)反应放出气体体积为气体总体积一半为30mL,根据图象判断需要的时间;
(3)反应放出气体体积为气体总体积的
| 3 |
| 4 |
(4)根据浓度对反应速率的影响判断A、B、C、D各点反应速率大小;
(5)随着反应的进行,溶液的浓度逐渐降低,反应速率逐渐减小.
解答:
解:(1)由反应方程式为:2H2O2
2H2O+O2↑,该反应为不可逆反应,在4min后,收集到的气体体积不再增加,说明过氧化氢完全分解,由图象可知,生成氧气的体积为60mL,
故答案为:60ml;
(2)由图象可知,当时间进行到1min时,生成氧气的体积为30mL,此时生成的氧气为总体积的一半,需要的时间为1min,
故答案为:1min;
(3)生成的总体积为60mL,反应放出气体体积为气体总体积的
时,生成的氧气体积为45mL,需要的时间为2min,
故答案为:2min;
(4)反应物浓度大小决定反应速率大小,随着反应的进行,双氧水的浓度逐渐减小,反应速率也随着减小,
故答案为:D>C>B>A;
(5)浓度越大,反应速率越大,反之越小,随着反应进行,反应物的浓度逐渐减小,则速率逐渐减小,
故答案为:随着反应的进行,双氧水的浓度逐渐减小,反应速率也随着减小.
| ||
故答案为:60ml;
(2)由图象可知,当时间进行到1min时,生成氧气的体积为30mL,此时生成的氧气为总体积的一半,需要的时间为1min,
故答案为:1min;
(3)生成的总体积为60mL,反应放出气体体积为气体总体积的
| 3 |
| 4 |
故答案为:2min;
(4)反应物浓度大小决定反应速率大小,随着反应的进行,双氧水的浓度逐渐减小,反应速率也随着减小,
故答案为:D>C>B>A;
(5)浓度越大,反应速率越大,反之越小,随着反应进行,反应物的浓度逐渐减小,则速率逐渐减小,
故答案为:随着反应的进行,双氧水的浓度逐渐减小,反应速率也随着减小.
点评:本题考查过氧化氢分解的速率曲线,题目难度不大,主要考查浓度对反应速率的影响,正确分析图象的曲线变化是解答本题的关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
根据表中提供的部分短周期元素原子半径及主要化合价的信息,判断以下叙述中正确的是( )
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A、氢化物的沸点为H2T<H2R |
| B、单质与稀盐酸反应的速率为L>Q |
| C、M与T形成的化合物具有两性 |
| D、L2+与R2-的核外电子数相等 |
向硫酸铝铵溶液中逐滴加入Ba(OH)2溶液,可能发生的反应的离子方程式是( )
| A、NH4++SO42-+Ba2++OH-→BaSO4↓+NH3?H2O |
| B、2Al3++3SO42-+3Ba2++6OH-→3BaSO4↓+2Al(OH)3↓ |
| C、Al3++2SO42-+2Ba2++4OH-→2BaSO4↓+AlO2-+2H2O |
| D、NH4++Al3++2SO42-+2Ba2++4OH-→2BaSO4↓+Al(OH)3↓+NH3?H2O |
“碳捕捉技术”是指通过一定的方法将工业生产中产生的CO2分离出来并利用.如可利用NaOH溶液来“捕捉”CO2,其基本过程如下图所示(部分条件及物质未标出).下列有关该方法的叙述中不正确的是( )
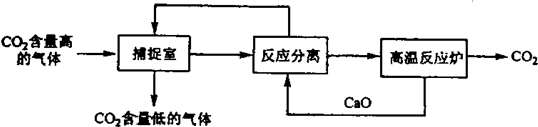

| A、能耗大是该方法的一大缺点 |
| B、整个过程中,既有氧化还原反应又有非氧化还原反应 |
| C、“反应分离”环节中,分离的基本操作是过滤 |
| D、整个过程中,有2种物质可以循环利用 |