题目内容
按要求回答下列问题:
(1)某500ml的Na2SO4溶液中含9.2克Na+,则该溶液中SO42-的物质的量为 mol,加水稀释为1L的溶液,取出其中10mL,则Na+物质的量浓度为 mol?L-1.
(2)用于分离或提纯物质的方法有:A.蒸馏(分馏) B.萃取C.过滤 D.蒸发 E.分液.下列各组混合物的分离或提纯应选用上述哪一种方法最合适?(填方法的标号)
①除去Ca(OH)2溶液中悬浮的CaCO3微粒
②分离四氯化碳与水的混合物
③分离汽油和煤油
④分离碘水中的碘单质 .
(1)某500ml的Na2SO4溶液中含9.2克Na+,则该溶液中SO42-的物质的量为
(2)用于分离或提纯物质的方法有:A.蒸馏(分馏) B.萃取C.过滤 D.蒸发 E.分液.下列各组混合物的分离或提纯应选用上述哪一种方法最合适?(填方法的标号)
①除去Ca(OH)2溶液中悬浮的CaCO3微粒
②分离四氯化碳与水的混合物
③分离汽油和煤油
④分离碘水中的碘单质
考点:物质的量浓度,物质的分离、提纯的基本方法选择与应用
专题:物质的量浓度和溶解度专题,化学实验基本操作
分析:(1)根据钠的质量计算钠的物质的量,根据C=
计算钠离子的物质的量浓度,硫酸钠溶液中钠离子浓度与硫酸根离子浓度之比是2:1,求出硫酸根离子的浓度,根据n=cV求硫酸根的物质的量;根据稀释前后溶质的物质的量不变求稀释后钠离子的物质的量浓度,依据溶液均一性判断所取溶液的浓度;
(2)A.相互溶解的液体,沸点不同,利用蒸馏法分离;
B.溶质在互不相溶的溶剂里溶解度不同的,可利用萃取法分离;
C.不溶性固体与溶液常用过滤法分离;
D.蒸发适用于从溶液中得到固体溶质,是从溶液中将溶质分离出来的方法;
E.对应互不相溶的分层的液体,利用分液法分离.
| n |
| V |
(2)A.相互溶解的液体,沸点不同,利用蒸馏法分离;
B.溶质在互不相溶的溶剂里溶解度不同的,可利用萃取法分离;
C.不溶性固体与溶液常用过滤法分离;
D.蒸发适用于从溶液中得到固体溶质,是从溶液中将溶质分离出来的方法;
E.对应互不相溶的分层的液体,利用分液法分离.
解答:
解:(1)钠离子的物质的量=
=0.4mol,则钠离子浓度=
=0.8molmo,/L,硫酸钠溶液中钠离子浓度与氯酸根离子浓度之比是2:1,所以该溶液中SO42-的物质的量为0.4mol/L,硫酸根离子的物质的量=0.4mol/L×0.5L=0.2mol;
溶液稀释中存在C1V1=C2V2,0.8mol/L×0.5L=C2×1L,解C2=0.4mol/L,溶液具有均一性,加水稀释为1L的溶液,取出其中10mL,则Na+物质的量浓度为0.4mol/L;
故答案为:0.2;0.4;
(2)①Ca(OH)2溶液中悬浮的CaCO3微粒,用过滤的方法分离;
②四氯化碳与水的互不相溶且分层,用分液法分离;
③汽油和煤油相互溶解,沸点不同,用蒸馏的方法分离;
④碘在水中的溶解度小,在四氯化碳中溶解度大,用萃取法分离;
故答案为:①C; ②E;③A; ④B.
| 9.2g |
| 23g/mol |
| 0.4mol |
| 0.5L |
溶液稀释中存在C1V1=C2V2,0.8mol/L×0.5L=C2×1L,解C2=0.4mol/L,溶液具有均一性,加水稀释为1L的溶液,取出其中10mL,则Na+物质的量浓度为0.4mol/L;
故答案为:0.2;0.4;
(2)①Ca(OH)2溶液中悬浮的CaCO3微粒,用过滤的方法分离;
②四氯化碳与水的互不相溶且分层,用分液法分离;
③汽油和煤油相互溶解,沸点不同,用蒸馏的方法分离;
④碘在水中的溶解度小,在四氯化碳中溶解度大,用萃取法分离;
故答案为:①C; ②E;③A; ④B.
点评:本题考查了离子的物质的量浓度相关计算,分离物质常用得方法,题目简单,难度不大,注意不同分离方法分离的物质的特点.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目
 2011年9月,中国女科学家屠呦呦获得被誉为诺贝尔奖“风向标”的拉斯克奖,这是中国医学界迄今为止获得的世界级最高级大奖.她获奖理由是:“因为创制新型抗疟药--青蒿素和双氢蒿素,挽救了全球特别是发展中国家的数百万人的生命.”已知结构如右图所示,则下列说法正确的是( )
2011年9月,中国女科学家屠呦呦获得被誉为诺贝尔奖“风向标”的拉斯克奖,这是中国医学界迄今为止获得的世界级最高级大奖.她获奖理由是:“因为创制新型抗疟药--青蒿素和双氢蒿素,挽救了全球特别是发展中国家的数百万人的生命.”已知结构如右图所示,则下列说法正确的是( )| A、青蒿素与维生素C一样易溶于水 |
| B、青蒿素的晶体为分子晶体,其化学式为C16H20O5 |
| C、青蒿素不能与NaOH溶液反应 |
| D、青蒿素中含有过氧键,一定条件下有氧化性 |
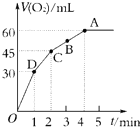 加入0.1mol MnO2粉末于50mL过氧化氢溶液(H2O2,ρ=1.1g?mL-1)中,在标准状况下放出气体的体积和时间的关系如图所示.
加入0.1mol MnO2粉末于50mL过氧化氢溶液(H2O2,ρ=1.1g?mL-1)中,在标准状况下放出气体的体积和时间的关系如图所示.