题目内容
16.固体X中可能含有MgCl2、Na2CO3、K2SO3、KAlO2中的一种或几种.为确定该固体粉末的成分,现取X进行下列实验,实验过程及现象如图:根据上述实验,下列说法正确的是( )
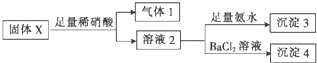
| A. | 气体1可能为SO2和CO2的混合物 | |
| B. | 沉淀3可能为Mg(OH)2和Al(OH)3的混合物 | |
| C. | 沉淀4可能为BaCO3、BaSO3或二者混合物 | |
| D. | 固体粉末X中一定有Na2CO3,可能有KAlO2 |
分析 固体X中加入过量的硝酸,得溶液2,加入氯化钡生成沉淀4,说明固体中含有K2SO3,加入稀硝酸还有气体生成,则一定含有Na2CO3,向溶液2中加入氨水有沉淀生成,沉淀可能是Mg(OH)2和Al(OH)3的混合物,
向溶液2中加入氯化钡有白色沉淀生成,固体中一定含有K2SO3;
所以固体中一定含有K2SO3、Na2CO3,可能含有Mg(OH)2和Al(OH)3中的一种或两种,
A、稀硝酸的强氧化性,气体1不可能为SO2;
B、沉淀3为Al(OH)3或Mg(OH)2或二者都有;
C、能和氯化钡反应产生的不溶于硝酸的白色沉淀是硫酸钡;
D、固体粉末X中一定有K2SO3、Na2CO3,可能有KAlO2.
解答 解:固体X中加入过量的硝酸,得溶液2,加入氯化钡生成沉淀4,说明固体中含有K2SO3,加入稀硝酸还有气体生成,则一定含有Na2CO3,向溶液2中加入氨水有沉淀生成,沉淀可能是Mg(OH)2和Al(OH)3的混合物,
向溶液2中加入氯化钡有白色沉淀生成,固体中一定含有K2SO3;
所以固体中一定含有K2SO3、Na2CO3,可能含有Mg(OH)2和Al(OH)3中的一种或两种,
A、稀硝酸的强氧化性,气体1不可能为SO2,两者要发生氧化还原反应,故A错误;
B、沉淀3为Al(OH)3或Mg(OH)2或二者都有,故B正确;
C、沉淀4可为BaSO4,故C错误;
D、固体粉末X中一定有K2SO3、Na2CO3,可能有KAlO2,故D正确;
故选BD.
点评 解此类题,离子的共存问题方面进行分析,熟练掌握常见的盐的性质,而不溶于硝酸的白色沉淀只有硫酸钡和氯化银两种物质是解题的关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.在体积为2L的密闭容器中通入0.4molSO2和0.2molO2发生反应2SO2+O2?2SO3,下列叙述正确的是( )
| A. | 若反应中加入的是18O2,达到平衡后SO2中不可能含有18O | |
| B. | 平衡时,SO3的浓度可能为0.2mol/L | |
| C. | 当不再生成SO3时反应达到平衡 | |
| D. | 温度不变,改变SO2和O2的加入量,达到平衡时$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})(C{O}_{2})}$不变 |
5.相同浓度的下列溶液:①NH4Cl、②NH4HCO3、③NH4HSO4、④(NH4)2CO3中,c(NH4+)由大到小的顺序是( )
| A. | ④>③>②>① | B. | ④>③>①>② | C. | ④>②>①>③ | D. | ④>②>③>① |
11.下列溶液中的离子一定能大量共存的是( )
| A. | 在加入铝粉能产生氢气的溶液中:NH4+、Fe2+、SO42-、NO3- | |
| B. | 室温下由水电离出的氢离子浓度c(H+)=1×10-14mol/L的溶液中:Ba2+、NO3-、K+、ClO- | |
| C. | 能使酚酞变红色的溶液中:Na+、K+、AlO2-、CO32- | |
| D. | 在c(HCO3-)=0.1 mol•L-1的溶液中:NH4+、AlO2-、Cl-、NO3- |
1.把a L含硫酸铵的硝酸铵的混合液分成两等份.一份加入b mol NaOH并加热,恰好把NH3全部赶走;另一份消耗c molBaCl2时,SO${\;}_{4}^{2-}$恰好沉淀完全,则原溶液中NO${\;}_{3}^{-}$的浓度为( )
| A. | $\frac{b-2c}{a}$ mol/L | B. | $\frac{2b-4c}{a}$mol/L | C. | $\frac{4c-2b}{a}$ mol/L | D. | $\frac{b-4c}{a}$mol/L |
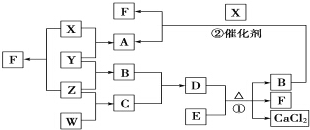 X、Y、Z、W均为气体单质,A、B、C均为无色气体化合物,D、E均为白色固体,F在通常情况下为无色无味的液体,它们有如下的转化关系:
X、Y、Z、W均为气体单质,A、B、C均为无色气体化合物,D、E均为白色固体,F在通常情况下为无色无味的液体,它们有如下的转化关系: ,F中的化学键类型为共价键.
,F中的化学键类型为共价键.