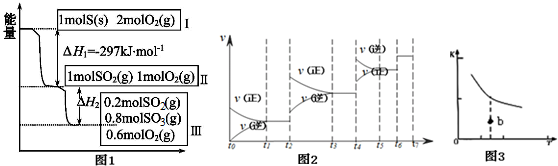
题目内容
由铜片、锌片和200mL稀H2SO4组成的原电池中,若锌片发生电化学腐蚀,则当铜片上放出3.36L(标态)气体时,硫酸恰好全部作用完.试计算:
(1)产生这些气体消耗了多少克锌?
(2)有多少mol电子通过了导线?
(3)200mL稀H2SO4的物质的量浓度是多少?
(1)产生这些气体消耗了多少克锌?
(2)有多少mol电子通过了导线?
(3)200mL稀H2SO4的物质的量浓度是多少?
考点:原电池和电解池的工作原理
专题:电化学专题
分析:该原电池中,锌电极上电极反应式为Zn-2e-=Zn2+,铜电极上电极反应式为2H++2e-=H2↑,则电池反应式为Zn+2H+=H2↑+Zn2+,
(1)根据氢气和锌之间的关系式计算锌的质量;
(2)根据氢气和转移电子之间的关系式计算转移电子的物质的量;
(3)根据氢原子守恒计算硫酸的浓度.
(1)根据氢气和锌之间的关系式计算锌的质量;
(2)根据氢气和转移电子之间的关系式计算转移电子的物质的量;
(3)根据氢原子守恒计算硫酸的浓度.
解答:
解:该原电池中,锌电极上电极反应式为Zn-2e-=Zn2+,铜电极上电极反应式为2H++2e-=H2↑,则电池反应式为Zn+2H+=H2↑+Zn2+,
(1)设参加反应的Zn的质量为x,
Zn+2H+=H2↑+Zn2+
65g 22.4L
x 3.36L
=
解得:x=9.75g
答:消耗锌的质量9.75g;
(2)设转移电子的物质的量为y,
Zn+2H+=H2↑+Zn2+转移电子
22.4L 2mol
3.36L y
=
解得:y=0.30mol,
答:通过电子的物质的量为0.30mol;
(3)根据氢原子守恒得H2SO4~H2,则c(H2SO4)=
=0.75 mol?L-1,
答:原硫酸的浓度为0.75 mol?L-1.
(1)设参加反应的Zn的质量为x,
Zn+2H+=H2↑+Zn2+
65g 22.4L
x 3.36L
| 65 |
| x |
| 22.4 |
| 3.36 |
答:消耗锌的质量9.75g;
(2)设转移电子的物质的量为y,
Zn+2H+=H2↑+Zn2+转移电子
22.4L 2mol
3.36L y
| 22.4L |
| 3.36L |
| 2mol |
| y |
解得:y=0.30mol,
答:通过电子的物质的量为0.30mol;
(3)根据氢原子守恒得H2SO4~H2,则c(H2SO4)=
| ||
| 0.2L |
答:原硫酸的浓度为0.75 mol?L-1.
点评:本题以原电池原理为载体考查了物质的量的有关计算,根据各个物理量之间的关系来分析解答,题目难度不大.

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目
下列各组物理量中,都不随取水量的变化而变化的是( )
| A、水的沸点;蒸发水所需热量 |
| B、水的密度;水中通入足量CO2后溶液的pH |
| C、水的体积;水的质量 |
| D、水的物质的量;水的摩尔质量 |
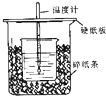 用50mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: