题目内容
19.日常生活中有一种消毒液被广泛使用,该消毒液无色,pH大于7,对某些有色物质有漂白作用.从下列选项中选出你认为它可能的有效成分是( )| A. | NaClO | B. | Na2CO3 | C. | KMnO4 | D. | H2O2 |
分析 该消毒液无色,pH大于7,对某些有色物质有漂白作用,只有NaClO溶液符合,水解显碱性,且具有强氧化性,以此来解答.
解答 解:A.NaClO为无色溶液,水解显碱性,且具有强氧化性,可漂白有色物质,故A选;
B.不具有漂白性,故B不选;
C.KMnO4为紫色,与无色不符,且不显碱性,故C不选;
D.H2O2的pH<7,故D不选;
故选A.
点评 本题考查物质的性质及应用,为高频考点,把握物质的性质、应用、盐类水解等为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
9.用NA表示阿伏加德罗常数,下列关于0.2mol•L-1K2SO4溶液的正确说法是( )
| A. | 1 L溶液中K+浓度是0.4 mol•L-1 | |
| B. | 溶液中含有0.4NA个K+ | |
| C. | 1 L溶液中所含K+、SO42-总数为0.3NA | |
| D. | 2 L溶液中SO42-浓度是0.4 mol•L-1 |
10.下列物质的水溶液能导电,但该物质属于非电解质的是( )
| A. | Cu | B. | CO2 | C. | NH3 | D. | CH3CH2OH(乙醇) |
7.向只含有Fe3+、Cu2+、H+各0.1mol及a mol SO42-的某溶液中(不考虑水的电离),加入足量锌粉,搅拌使其充分反应,下列说法中正确的是( )
| A. | 当消耗0.1 mol Zn时,得到的还原产物为0.1 mol | |
| B. | 当溶液中不再产生气泡时,溶液中大量存在的阳离子是Zn2+ | |
| C. | 当有第三种单质生成时,消耗的锌粉质量至少大于13 g | |
| D. | 反应结束时,可得到0.25 mol ZnSO4 |
4.下列说法错误的是( )
| A. | 所有铵盐受热均可分解,产物均有NH3 | |
| B. | 所有铵盐都易溶于水,不是所有铵盐中的氮都呈-3价 | |
| C. | NH4Cl溶液中加入NaOH浓溶液供热,反应的离子方程式为NH4+OH-$\frac{\underline{\;加热\;}}{\;}$NH3↑+H2O | |
| D. | NH4Cl和NaCl的固体混合物可用加热法分离 |
4.从某含有FeCl2、FeCl3、CuCl2的工业废液中回收铜并制备氯化铁晶体的流程如图:
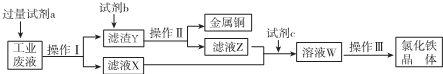
则下列说法正确的是( )

则下列说法正确的是( )
| A. | 试剂a是铁、试剂b是稀硫酸 | |
| B. | 操作I、操作Ⅱ、操作Ⅲ所用仪器相同 | |
| C. | 试剂c可以是H2O2溶液或氯气 | |
| D. | 用酸性KMnO4溶液可检验溶液W中是否还有Fe2+ |
1.1mol有机物 与足量的氢气和新制备的氢氧化铜反应,消耗的氢气与氢氧化铜的量分别为( )
与足量的氢气和新制备的氢氧化铜反应,消耗的氢气与氢氧化铜的量分别为( )
 与足量的氢气和新制备的氢氧化铜反应,消耗的氢气与氢氧化铜的量分别为( )
与足量的氢气和新制备的氢氧化铜反应,消耗的氢气与氢氧化铜的量分别为( )| A. | 1 mol、2 mol | B. | 1 mol、4 mol | C. | 3 mol、2 mol | D. | 3 mol、4 mol |
2.下列离子方程式正确的是( )
| A. | 向漂白液中通入少量二氧化碳:ClO-+H2O+CO2═${CO}_{3}^{2-}$+2HClO | |
| B. | 常温时偏铝酸钠溶液pH>7:${AlO}_{2}^{-}$+2H2O═Al(OH)3↓+OH- | |
| C. | 等物质的量浓度的FeI2溶液与溴水等体积混合:2Fe2++2I-+2Br2═2Fe3++I2+4Br- | |
| D. | 向硫酸氢钠溶液中滴加Ba(OH)2溶液恰好至沉淀完全:H++${SO}_{4}^{2-}$+Ba2++OH-═BaSO4↓+H2O |