题目内容
下列解释实验事实的化学方程式正确的是( )
A、5mol Fe和4mol Cl2反应:5Cl2+4Fe
| ||||
| B、2mol KMnO4和3mol H2O2在酸性条件下反应:2MnO4-+3H2O2+6H+═Mn2++4O2↑+6H2O | ||||
| C、在电解液为氢氧化钾的甲醇燃料电池内电路中,阳极的电极反应式为:CH3OH-6e-+8OH-═CO32-+6H2O | ||||
| D、向NaAlO2溶液中通入过量CO2:CO2+3H2O+2AlO2-═2Al(OH)3↓+CO32- |
考点:离子方程式的书写
专题:离子反应专题
分析:A.Fe在Cl2中燃烧,无论量的多少只生成FeCl3;
B.电荷、电子不守恒;
C.碱性条件下,负极上甲醇失电子生成碳酸根离子;
D.过量CO2与CO32-生成碳酸氢根离子.
B.电荷、电子不守恒;
C.碱性条件下,负极上甲醇失电子生成碳酸根离子;
D.过量CO2与CO32-生成碳酸氢根离子.
解答:
解:A.Fe在Cl2中燃烧反应只生成FeCl3不会生成FeCl2,正确的为:2Fe+3Cl2
2FeCl3,故A错误;
B.电荷不守恒,正确的为:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O,故B错误;
C.碱性条件下,负极上甲醇失电子生成碳酸根离子,所以负极的电极反应式为:CH3OH-6e-+8OH-=CO32-+6H2O,故C正确;
D.过量CO2与CO32-生成碳酸氢根离子,正确的为:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-,故D错误;
故选C.
| ||
B.电荷不守恒,正确的为:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O,故B错误;
C.碱性条件下,负极上甲醇失电子生成碳酸根离子,所以负极的电极反应式为:CH3OH-6e-+8OH-=CO32-+6H2O,故C正确;
D.过量CO2与CO32-生成碳酸氢根离子,正确的为:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-,故D错误;
故选C.
点评:本题离子方程式的书写,明确发生的反应是解答本题的关键,注意与量有关的离子反应即可解答,题目难度中等.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
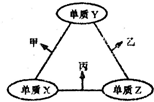 x、y、z三种短周期元素的原子半径依次变小,原子序数之和为16;这三种元素形成的常见单质分别为X、Y、Z,它们在适当条件下可发生如图所示转化关系;其中乙和丙均为l0电子气体分子,且二者相遇生成弱碱.下列说法正确的是( )
x、y、z三种短周期元素的原子半径依次变小,原子序数之和为16;这三种元素形成的常见单质分别为X、Y、Z,它们在适当条件下可发生如图所示转化关系;其中乙和丙均为l0电子气体分子,且二者相遇生成弱碱.下列说法正确的是( )| A、X元素位于第ⅣA族 |
| B、热稳定性:乙<丙 |
| C、甲和丙可能发生氧化还原反应 |
| D、分子乙中各原子均达8电子稳定结构 |
下列离子方程式书写不正确的是( )
| A、NaOH溶液与SO2反应,当n(NaOH):n(SO2)=4:3时,4OH-+3SO2═SO32-+2HSO3-+H2O |
| B、CuCl2溶液与Na2S溶液2:1反应:Cu2++S2-═CuS↓ |
| C、1mol?L-1的NaAlO2溶液和2.5mol?L-1的盐酸等体积互相均匀混合:2AlO2-+5H+═Al(OH)3↓+Al3++H2O |
| D、Cl2与FeBr2溶液反应,当n(Cl2):n(FeBr2)=1:1时:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- |
下列有关实验原理、方法和结论都正确的是( )
| A、向溴水中滴入植物油,振荡后,油层显无色,说明溴不溶于油脂 |
| B、向蛋白质溶液中加入硫酸铜溶液,将得到的沉淀分离出来,再加水可重新溶解 |
| C、pH都为3的酸HA和HB分别与足量Mg反应,HA放出的H2多,说明酸性HA<HB |
| D、淀粉在稀硫酸的作用下水解后,加入氢氧化钠使溶液呈碱性,再加入新制Cu(OH)2后加热,若有砖红色沉淀生成,则淀粉已经开始水解 |
下列有关叙述正确的是( )
| A、碱性锌锰电池中,MnO2是催化剂 |
| B、银锌纽扣电池工作时,Ag2O被还原为Ag |
| C、放电时,铅酸蓄电池中硫酸浓度不断增大 |
| D、电镀时,待镀的金属制品表面发生还原反应 |
Q、W、X、Y、Z是原子序数依次增大的短周期元素,X的焰色反应呈黄色.Q元素的原子最外层电子数是其内层电子数的2倍.W、Z最外层电子数相同,Z的核电荷数是W的2倍.元素Y的合金是日常生活中使用最广泛的金属材料之一,下列说法正确的是( )
| A、原子半径的大小顺序:rX>rY>rW>rQ |
| B、X、Y的最高价氧化物的水化物之间不能发生反应 |
| C、元素Q和Z能形成QZ2型的共价化合物 |
| D、Z元素的氢化物稳定性大于W元素的氢化物稳定性 |
下列说法正确的是( )
| A、常温常压下,16g O3含有NA个O3 |
| B、1mol?L-1的Ca(ClO)2溶液中含ClO-数目为2NA |
| C、标准状况下,22.4L HCl溶于1L水中所得的盐酸含有NA个HCl分子 |
| D、1mol Mg在空气中完全燃烧生成MgO和Mg3N2,失去2NA个电子 |