题目内容
12.将一定量的CuS投入足量的HNO3中,收集到标准状况下的气体VL向反应后的溶液中加人足量的NaOH,产生蓝色沉淀,经过滤、洗涤、灼烧,得到CuO16g,若上述气体为NO和NO2的混合物,且体积比为1:1,则V为( )| A. | 9.0L | B. | 13.44L | C. | 17.92L | D. | 16.8L |
分析 得到CuO16g,n(CuO)=$\frac{16g}{80g/mol}$=0.2mol,由Cu原子守恒可知n(CuS)=0.2mol,气体为NO和NO2的混合物,且体积比为1:1,则S的失电子数等于N的得电子数,以此计算.
解答 解:得到CuO16g,n(CuO)=$\frac{16g}{80g/mol}$=0.2mol,由Cu原子守恒可知n(CuS)=0.2mol,气体为NO和NO2的混合物,且体积比为1:1,设NO为xmol、NO2为xmol,
CuS中S的化合价由-2价上升到+6价,
由电子守恒可知,0.2×[6-(-2)]=3x+x,
解得x=0.4mol
故气体体积V=0.4mol×2×22.4L/mol=17.92L,
故选C.
点评 本题考查氧化还原反应的计算,为高频考点,把握反应中元素的化合价变化及电子守恒为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.设NA为阿伏伽德罗常数的值,下列有关叙述正确的是( )
| A. | 标准状况下,22.4LHF中含有的分子数为NA | |
| B. | 常温常压下,硝酸与铜反应得到NO2、N2O4共23g,则铜失去的电子数为0.5NA | |
| C. | 标准状况下,8.96L平均相对分子质量为3.5的H2与D2含有的中子数为0.3NA | |
| D. | 0.1L18mol/L浓硫酸与足量金属铜在加热条件下充分反应,生成0.9NA个SO2分子 |
3.下列实验中,操作和现象均正确且能实现相应实验目的是( )
| 选项 | 实验目的 | 操作 | 现象 |
| A | 验证BaSO3难溶于水 | 将SO2通入Ba(NO3)2溶液中 | 有白色沉淀生成 |
| B | 验证非金属性:Br>I | 将溴水滴加到淀粉KI溶液中 | 溶液变蓝 |
| C | 验证SO2的漂白性 | 将SO2通入氯水中 | 氯水褪色 |
| D | 验证某化合物是钠盐 | 将该化合物在酒精灯上灼烧 | 焰色为黄色 |
| A. | A | B. | B | C. | C | D. | D |
20.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 常温常压下,lmoI丙烷共用电子对数为10 NA | |
| B. | 0.5 moI甲烷和0.5 mol乙酸完全燃烧消耗的O2分子数都为0.2NA | |
| C. | 标准状况下,1L辛烷充分燃烧后生成气态产物的分子数为$\frac{8}{22.4}$NA | |
| D. | 1 mol甲醇与足量钠反应,转移电子数目为2 NA |
7.下列说法不正确的是( )
| A. | 通过对苯燃烧和甲烷燃烧现象的对比,可以判断两种物质中含碳量的高低 | |
| B. | 苯不能使酸性高锰酸钾溶液褪色,说明苯分子中没有碳碳双键 | |
| C. | 甲烷分子是空间正四面体形,苯分子是平面形 | |
| D. | 苯不能与Br2(CCl4)发生加成反应,故苯为饱和烃 |
9.下列离子方程式书写正确的是( )
| A. | 氧化铁与稀硫酸反应:Fe2O3+6H+═Fe2++3H2O | |
| B. | 石灰石溶于盐酸中:CO32-+2H+═CO2↑+H2O | |
| C. | 硫酸铜溶液与氢氧化钠溶液混合:Cu2++2OH-═Cu(OH)2↓ | |
| D. | 碳酸氢钙溶液与盐酸反应:HCO3-+H+═H2O+CO2↑ |
7.在含有大量Ba2+、H+、NO${\;}_{3}^{-}$的溶液中,还可能大量共存的离子是( )
| A. | Fe2+ | B. | NH${\;}_{4}^{+}$ | C. | HCO${\;}_{3}^{-}$ | D. | OH- |
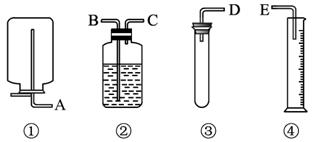 现有药品和如图装置:质量为wg的锌片、稀H2SO4、无水硫酸铜和蒸馏水,
现有药品和如图装置:质量为wg的锌片、稀H2SO4、无水硫酸铜和蒸馏水,