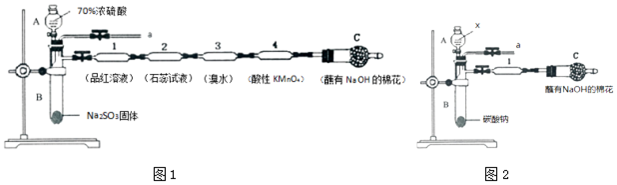
题目内容
17.下列有关溶液组成的描述合理的是( )| A. | 无色溶液中可能大量存在Al3+、NH4+、Cl-、S2- | |
| B. | pH=1的溶液中大量存在Na+、NH4+、SiO32-、I- | |
| C. | 弱碱性溶液中可能大量存在Na+、K+、Cl-、HCO3- | |
| D. | 0.1mol•L-1NaAlO2溶液中可能大量存在Na+、H+、Cl-、SO42- |
分析 A.离子之间相互促进水解;
B.pH=1的溶液,显酸性;
C.弱碱性溶液中该组离子之间不反应;
D.离子之间结合生成沉淀.
解答 解:A.Al3+、S2-相互促进水解,不能共存,故A不选;
B.pH=1的溶液,显酸性,不能大量存在SiO32-,故B不选;
C.弱碱性溶液中该组离子之间不反应,可大量共存,故C选;
D.H+、AlO2-结合生成沉淀,不能共存,故D不选;
故选C.
点评 本题考查离子共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意水解及复分解反应的判断,题目难度不大.

练习册系列答案
相关题目
7.在含有大量Ba2+、H+、NO${\;}_{3}^{-}$的溶液中,还可能大量共存的离子是( )
| A. | Fe2+ | B. | NH${\;}_{4}^{+}$ | C. | HCO${\;}_{3}^{-}$ | D. | OH- |
8.下列物质中,既含有极性键又含有非极性键的是( )
| A. | CO2 | B. | CH4 | C. | C2H4 | D. | NH4Cl |
12.恒容密闭容器中发生如下反应:2NH3(g)+NO2(g)?2N2(g)+3H2O(g)△H<0,下列有关说法正确的是( )
| A. | 上述热化学方程式说明反应物的总键能大于生成物的总键能 | |
| B. | 达平衡后再通入NH3,则平衡正向移动,NH3转化率减小 | |
| C. | 达平衡后升温,则逆反应速率加快,正反应速率减慢,平衡逆向移动 | |
| D. | 达平衡后加入催化剂能同时增大正逆反应速率,平衡发生移动 |
8.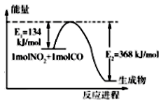 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题.
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题.
(1)如图是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图(图中涉及物质为气态),请写出NO2和CO反应的热化学方程式NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ•mol-1.
(2)在体积为3L的恒容密闭容器中,投入4molN2和9molH2,在一定条件下合成氨,不同温度下测得的数据如表所示:
已知:破坏1molN2(g)和3molH2(g)中的化学键消耗的总能量小于破坏2molNH3(g)中的化学键消耗的能量.
①则T1<T2 (填“>”“<”或“=”)
②在T2K下,经过5min达到化学平衡状态,则0~5min内H2的平均速率v(H2)=0.2mol•L-1•min-1.
平衡时N2的转化率α(N2)=25%.若再增加氢气浓度,该反应的平衡常数将不变(填“增大”、“减小”或“不变”).
(3)以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制造新型燃料电池,放电过程中,溶液中NH4+浓度逐渐增大,写出该电池的正极反应式:N2+8H++6e-═2NH4+.
(4)已知室温下当NH4Cl溶液的浓度小于0.1mol/L时,其pH>5.1.现用0.1mol/L的盐酸滴定10mL0.05mol/K的氨水,用甲基橙做指示剂达到终点时所用盐酸的量应是大于5mL.(填“大于”、“小于”或“等于”),此时溶液中离子浓度大小顺序为c (Cl-)>c(NH4+)>c(H+)>c(OH-).
 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题.
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题.(1)如图是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图(图中涉及物质为气态),请写出NO2和CO反应的热化学方程式NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ•mol-1.
(2)在体积为3L的恒容密闭容器中,投入4molN2和9molH2,在一定条件下合成氨,不同温度下测得的数据如表所示:
| 温度(K) | 平衡时NH3的物质的量(mol) |
| T1 | 2.4 |
| T2 | 2.0 |
①则T1<T2 (填“>”“<”或“=”)
②在T2K下,经过5min达到化学平衡状态,则0~5min内H2的平均速率v(H2)=0.2mol•L-1•min-1.
平衡时N2的转化率α(N2)=25%.若再增加氢气浓度,该反应的平衡常数将不变(填“增大”、“减小”或“不变”).
(3)以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制造新型燃料电池,放电过程中,溶液中NH4+浓度逐渐增大,写出该电池的正极反应式:N2+8H++6e-═2NH4+.
(4)已知室温下当NH4Cl溶液的浓度小于0.1mol/L时,其pH>5.1.现用0.1mol/L的盐酸滴定10mL0.05mol/K的氨水,用甲基橙做指示剂达到终点时所用盐酸的量应是大于5mL.(填“大于”、“小于”或“等于”),此时溶液中离子浓度大小顺序为c (Cl-)>c(NH4+)>c(H+)>c(OH-).
5.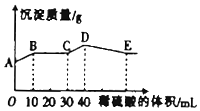 将由NaOH、BaCl2、Al2(SO4)3三种固体组成的混合物溶于足量的水中,充分溶解,向混合液中滴加1mol•L-1的稀硫酸,加入稀硫酸的体积与生成沉淀的质量关系如图所示.下列有关判断不正确的是( )
将由NaOH、BaCl2、Al2(SO4)3三种固体组成的混合物溶于足量的水中,充分溶解,向混合液中滴加1mol•L-1的稀硫酸,加入稀硫酸的体积与生成沉淀的质量关系如图所示.下列有关判断不正确的是( )
 将由NaOH、BaCl2、Al2(SO4)3三种固体组成的混合物溶于足量的水中,充分溶解,向混合液中滴加1mol•L-1的稀硫酸,加入稀硫酸的体积与生成沉淀的质量关系如图所示.下列有关判断不正确的是( )
将由NaOH、BaCl2、Al2(SO4)3三种固体组成的混合物溶于足量的水中,充分溶解,向混合液中滴加1mol•L-1的稀硫酸,加入稀硫酸的体积与生成沉淀的质量关系如图所示.下列有关判断不正确的是( )| A. | AB段发生反应的离子方程式为:Ba2++SO42-═BaSO4↓ | |
| B. | E点对应横坐标稀硫酸的体积为70mL | |
| C. | D点表示的沉淀的化学式为Al(OH)3、BaSO4 | |
| D. | E点沉淀比A点沉淀质量大2.33g |
6.广义的水解观认为:水解的物质和水分别离解成两部分,然后两两重新结合成新的物质,不出现元素化合价的变化.根据以上信息,下列物质水解后的产物错误的是( )
| A. | BaO2的水解产物是Ba(OH)2和H2O2 | B. | PCl3水解的产物是HClO和PH3 | ||
| C. | CaC2水解的产物是Ca(OH)2和C2H2 | D. | Al2S3水解的产物是Al(OH)3和H2S |