题目内容
16.某溶液中可能含有I-、NH4+、Cu2+、SO32-,向溶液中加入足量的溴水,反应后溶液仍呈无色,则下列关于溶液组成的判断正确的是( )| A. | 肯定不含I- | B. | 肯定不含NH4+ | C. | 肯定不含Cu2+ | D. | 肯定不含SO32- |
分析 还原性SO32->I-,溶液中加入足量溴水,溶液仍呈无色,说明一定含有SO32-,溶液中不可能含有I-离子,反应后溶液呈无色,说明不含Cu2+离子,根据溶液电中性,进一步判断其它离子是否存在.
解答 解:溴水具有强氧化性,可与I-、SO32-发生氧化还原反应,溶液中加入足量溴水,溶液仍呈无色,说明一定含有SO32-,不含有I-离子,含Cu2+离子的溶液呈蓝色,反应后溶液无色说明不含铜离子,根据溶液呈电中性可知,溶液中含有铵根离子,
综上所述,一定含SO32-、NH4+,一定不含I-、Cu2+,
故选AC.
点评 本题考查离子的共存,为高频考点,把握常见离子之间的反应为解答的关键,侧重复分解反应的离子共存及分析与应用能力的考查,注意溶液电中性的应用,题目难度不大.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
7.下列图示实验操作,能达到目的是( )
| A. |  检验K+的存在 | B. |  | C. |  蒸馏 蒸馏 | D. |  检查气密性 |
4.(1)二氧化硫的催化氧化的过程如图1所示,

其中a、c二步的化学方程式可表示为:SO2+V2O5?SO3+V2O4 4VOSO4+O2?2V2O5+4SO3.该反应的催化剂是V2O5(写化学式)
(2)压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为:SO2 7%,O2 11%,N2 82%):
当合成SO3的反应达到平衡后,改变某一外界条件(不改变SO2、O2和SO3的量),反应速率与时间的关系如图2所示.图中t1时引起平衡移动的条件可能是增大压强其中表示平衡混合物中SO3的含量最高的一段时间是t2-t3.
(3)550℃时,SO2转化为SO3的平衡转化率(α)与体系总压强(p)的关系如右图3所示.将2.0mol SO2和1.0mol O2置于5 L密闭容器中,反应达平衡后,体系总压强为0.10M Pa.试计算反应2SO3?2SO2+O2 在550℃时的平衡常数K=2.5×10-3.
反应达平衡后,下列措施中能使n(SO3)/n(SO2)增大的是CD
A.升高温度 B.充入He(g),使体系总压强增大
C.再充入2mol SO2和1mol O2 D.再充入1mol SO2和1mol O2
(4)SO3溶于水得到硫酸.在25°C下,将x mol•L-1的氨水与y mol•L-1的硫酸等体积混合,反应后溶液中显中性,则c(NH4+)=2c(SO42-)(填“>”、“<”或“=”);用含x和y的代数式表示出氨水的电离平衡常数$\frac{2×1{0}^{-7}y}{x-2y}$.

其中a、c二步的化学方程式可表示为:SO2+V2O5?SO3+V2O4 4VOSO4+O2?2V2O5+4SO3.该反应的催化剂是V2O5(写化学式)
(2)压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为:SO2 7%,O2 11%,N2 82%):
| 压强/MPa 温度/℃ | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2% | 99.6% | 99.7% | 99.9% |
| 500 | 93.5% | 96.9% | 97.8% | 99.3% |
| 600 | 73.7% | 85.8% | 89.5% | 96.4% |
(3)550℃时,SO2转化为SO3的平衡转化率(α)与体系总压强(p)的关系如右图3所示.将2.0mol SO2和1.0mol O2置于5 L密闭容器中,反应达平衡后,体系总压强为0.10M Pa.试计算反应2SO3?2SO2+O2 在550℃时的平衡常数K=2.5×10-3.
反应达平衡后,下列措施中能使n(SO3)/n(SO2)增大的是CD
A.升高温度 B.充入He(g),使体系总压强增大
C.再充入2mol SO2和1mol O2 D.再充入1mol SO2和1mol O2
(4)SO3溶于水得到硫酸.在25°C下,将x mol•L-1的氨水与y mol•L-1的硫酸等体积混合,反应后溶液中显中性,则c(NH4+)=2c(SO42-)(填“>”、“<”或“=”);用含x和y的代数式表示出氨水的电离平衡常数$\frac{2×1{0}^{-7}y}{x-2y}$.
1.下列有关说法不正确的是( )
| A. | 25℃时,0.1mol•L-1的三种溶液的pH关系为:pH(Na2CO3)>pH(NaHCO3)>pH(CH3COONa) | |
| B. | 25℃时,pH=5的CH3COOH溶液和pH=5的NH4Cl溶液,c(H+)相等 | |
| C. | 25℃时,BaCO3在纯水中的KSP比在Na2CO3溶液中的KSP大 | |
| D. | NaHCO3和Na2CO3混合溶液中,一定有c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) |
8.硫酸是一种重要的化工产品,硫酸的消耗量常被视为一个国家工业发展水平的一种标志.目前的重要生产方法是“接触法”,有关接触氧化反应2SO2+O2$?_{500℃}^{催化剂}$ 2SO3,的说法不正确的是( )
| A. | 该反应为可逆反应,故在一定条件下二氧化硫和氧气不可能全部转化为三氧化硫 | |
| B. | 达到平衡后,反应就停止了,故此时正、逆反应速率相等且均为零 | |
| C. | 一定条件下,向某密闭容器中加入2molSO2和1molO2,则从反应开始到达到平衡的过程中,正反应速率不断减小,逆反应速率不断增大,某一时刻,正、逆反应速率相等 | |
| D. | 在利用上述反应生产三氧化硫时,要同时考虑反应所能达到的限度和化学反应速率两方面的问题 |
5.现有下列三个图象:下列反应中符合下述全部图象的反应是( )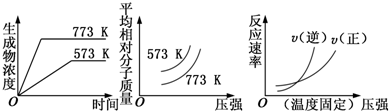

| A. | N2(g)+3H2(g)═2NH3(g)△H<0 | B. | 2SO3(g)?═?2SO2(g)+O2(g)△H>0 | ||
| C. | 4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H<0 | D. | H2(g)+CO(g)?═?C(s)+H2O(g)△H>0 |
6.化学与生产和生活密切相关,下列说法正确的是( )
| A. | 汽油、花生油都是油脂 | |
| B. | 碘元素遇淀粉溶液变蓝色 | |
| C. | 合成纤维、玻璃纤维和光导纤维都是有机高分子化合物 | |
| D. | 铵态氮肥不能与草木灰混合施用 |