题目内容
4.无机物A是一种固体,熔点178℃,30℃以下为浅黄色.经测定A(相对分子质量为184)含两种元素,原子个数比为1:1.隔绝空气迅速加热A将发生爆炸,爆炸后残留物B呈淡黄色.该淡黄色物质在空气中加热会燃烧并产生刺激性气味.在一定条件下,6.18g液体SCl2和2.72g气体C恰好完全反应生成A和单质B及6.42g离子化合物D,加热D发现无任何物质存在,D的水溶液的pH<7.已知气体C在标准状况下的密度为0.76g•L-1.(1)A的化学式N4S4,C的电子式
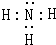 .
.(2)写出SCl2和气体C反应的化学方程式6SCl2+16NH3=N4S4+2S+12NH4Cl.
分析 隔绝空气迅速加热A将发生爆炸,爆炸后残留物B呈淡黄色,该淡黄色物质在空气中加热会燃烧并产生刺激性气味,则B为S;在一定条件下,6.18g液体SCl2和2.72g气体C恰好完全反应生成A和单质B及6.42克化合物D,气体C在标准状况下的密度为0.76g•L-1,C相对分子质量=0.76×22.4=17,可推知C为NH3,加热D发现无任何物质存在,D的水溶液的pH小于7,可推知D为NH4Cl,2.72g氨气中N原子物质的量=$\frac{2.72g}{17g/mol}$=0.16mol,6.42g氯化铵中N原子物质的量=$\frac{6.42g}{53.5g/mol}$=0.12mol<0.16mol,由元素守恒可知A中含有S、N元素,经测定A(相对分子质量为184)含两种元素,原子个数比为1:1,令A的分子式为(SN)x,则46x=184,解得x=4,故A分子式为N4S4.
解答 解:隔绝空气迅速加热A将发生爆炸,爆炸后残留物B呈淡黄色,该淡黄色物质在空气中加热会燃烧并产生刺激性气味,则B为S;在一定条件下,6.18g液体SCl2和2.72g气体C恰好完全反应生成A和单质B及6.42克化合物D,气体C在标准状况下的密度为0.76g•L-1,C相对分子质量=0.76×22.4=17,可推知C为NH3,加热D发现无任何物质存在,D的水溶液的pH小于7,可推知D为NH4Cl,2.72g氨气中N原子物质的量=$\frac{2.72g}{17g/mol}$=0.16mol,6.42g氯化铵中N原子物质的量=$\frac{6.42g}{53.5g/mol}$=0.12mol<0.16mol,由元素守恒可知A中含有S、N元素,经测定A(相对分子质量为184)含两种元素,原子个数比为1:1,令A的分子式为(SN)x,则46x=184,解得x=4,故A分子式为N4S4.
(1)由上述分析可知,A的化学式为N4S4,C为NH3,其电子式为: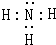 ,
,
故答案为:N4S4;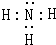 ;
;
(2)SCl2和气体NH3反应的化学方程式为:6SCl2+16NH3=N4S4+2S+12NH4Cl,
故答案为:6SCl2+16NH3=N4S4+2S+12NH4Cl.
点评 本题考查无机物推断,属于计算型推断,确定C为氨气是推断的关键,侧重考查学生分析计算能力,难度较大.

| A. | 0.4 mol•L-1•min-1 | B. | 0.6 mol•L-1•min-1 | ||
| C. | 0.2 mol•L-1•min-1 | D. | 无法计算 |
| A. | 只用水就可以鉴别四氯化碳、苯和乙醇 | |
| B. | C2H4、C3H6、C6H6分子中,所有原子处于同一平面上 | |
| C. | 光照条件下,氯气与乙烷发生化学反应,生成的产物有6种 | |
| D. | 有机物 与氯气发生取代反应,生成的一氯代物有5种 与氯气发生取代反应,生成的一氯代物有5种 |
| A. | 2H2(g)+O2(g)=2H2O(l)△H=-142.9 kJ•mol-1 | |
| B. | 2H2(g)+O2(g)=2H2O(l)△H=+571.6 kJ•mol-1 | |
| C. | H2(g)+$\frac{1}{2}$O2(g)=2H2O(g)△H=-285.8 kJ•mol-1 | |
| D. | H2(g)+$\frac{1}{2}$O2(g)=2H2O(l)△H=-285.8 kJ•mol-1 |
| A. | 在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4NA | |
| B. | 常温常压下,1.4gN2和CO的混合气体含有的电子数为0.7NA | |
| C. | 0.1 mol•L-1 CaCl2溶液中含有Clˉ离子的数目为0.2NA | |
| D. | 1molCl2参加反应转移电子数一定为2NA |
反应过程中,测得不同时间H2O2的物质的量浓度如表:
| t/min | 0 | 20 | 40 | 60 | 80 |
| c(H2O2)/mol•L-1 | 0.80 | 0.40 | 0.20 | 0.10 | 0.05 |
(2)该分解反应0─20min的平均反应速率v(H2O2)为0.02mol•L-1 min-1.
(3)如果反应所用的H2O2溶液为100mL,则共产生O2Cg.
A.0.08 B.0.16 C.1.2D.2.4.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 二 | ① | ② | ③ | ④ | ||||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(2)第三周期元素除⑩外原子半径最小的是Cl(填元素符号),这些元素的最高价氧化物对应水化物中碱性最强的是NaOH(填化学式,下同),具有两性的是Al(OH)3.
(3)⑤⑥⑦单质的活泼性顺序为Na>Mg>Al(填元素符号),判断的实验依据是单质与水或酸反应的剧烈程度(写出一种).
(4)⑧和⑨非金属性较强的是Cl,试用化学反应方程式说明Cl2+Na2S═2NaCl+S↓.
| A. | 20% | B. | 81.5% | C. | 18.5% | D. | 21.5% |