题目内容
14.在体积为2L的密闭容器中充入2mol的氮气与8mol氢气,一定条件下发生反应.4min后,测得容器内还剩余0.4mol的氮气,则用氮气表示该反应的反应速率为( )| A. | 0.4 mol•L-1•min-1 | B. | 0.6 mol•L-1•min-1 | ||
| C. | 0.2 mol•L-1•min-1 | D. | 无法计算 |
分析 4min后,测得容器内还剩余0.4mol的氮气,结合v=$\frac{△c}{△t}$解答.
解答 解:4min后,测得容器内还剩余0.4mol的氮气,则用氮气表示的反应速率为$\frac{\frac{(2mol-0.4mol)}{2L}}{4min}$=0.2mol•L-1•min-1,
故选C.
点评 本题考查化学反应速率的计算,为高频考点,把握浓度变化量及速率计算方法为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
5.A、B两种烃的混合物,当混合物的质量一定时,无论A、B以何种比例混合,完全燃烧产生的CO2的量均相等.在①同分异构体,②同系物,③具有相同的最简式,④含碳的质量分数相同,符合上述条件的组合是( )
| A. | ①②④ | B. | ①③④ | C. | ②③④ | D. | ①②③ |
9.在含有Na+、Cl-、CO32-离子的溶液中,能大量共存的离子是( )
| A. | K+ | B. | H+ | C. | Ca2+ | D. | Ag+ |
19.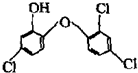 据报道,高露洁牙膏中含有的消毒剂三氯生遇含氯自来水能生成哥罗芳(三氯甲烷),哥罗芳能导致肝病甚至癌症,已知三氯生的结构简式如图所示,有关说法正确的是( )
据报道,高露洁牙膏中含有的消毒剂三氯生遇含氯自来水能生成哥罗芳(三氯甲烷),哥罗芳能导致肝病甚至癌症,已知三氯生的结构简式如图所示,有关说法正确的是( )
 据报道,高露洁牙膏中含有的消毒剂三氯生遇含氯自来水能生成哥罗芳(三氯甲烷),哥罗芳能导致肝病甚至癌症,已知三氯生的结构简式如图所示,有关说法正确的是( )
据报道,高露洁牙膏中含有的消毒剂三氯生遇含氯自来水能生成哥罗芳(三氯甲烷),哥罗芳能导致肝病甚至癌症,已知三氯生的结构简式如图所示,有关说法正确的是( )| A. | 三氯生的分子式为:C12H6Cl3O2 | |
| B. | 哥罗芳存在同分异构体 | |
| C. | 1mol三氯生最多能与4molNaOH溶液反应 | |
| D. | 三氯生遇FeCl3溶液显紫色 |
3.元素X、Y、Z原子序数之和为36,Y、Z在同一周期,X、Z在同一主族,X原子最外层电子数是Y原子最外层电子数的3倍.下列说法正确的是( )
| A. | 同主族元素中X的气态氢化物最稳定 | |
| B. | X、Y、Z所形成的化合物只含有共价键 | |
| C. | Z的最高价氧化物对应的水化物化学式为H3ZO4 | |
| D. | X与Y可形成共价化合物 |
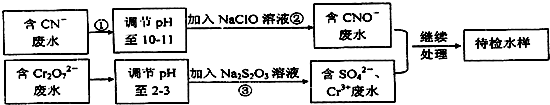
 (在横线上填相应的序号)
(在横线上填相应的序号) .
.