题目内容
13.如表是元素周期表的一部分,请针对表中所列标号为①~⑩的元素回答下列问题.| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 二 | ① | ② | ③ | ④ | ||||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(2)第三周期元素除⑩外原子半径最小的是Cl(填元素符号),这些元素的最高价氧化物对应水化物中碱性最强的是NaOH(填化学式,下同),具有两性的是Al(OH)3.
(3)⑤⑥⑦单质的活泼性顺序为Na>Mg>Al(填元素符号),判断的实验依据是单质与水或酸反应的剧烈程度(写出一种).
(4)⑧和⑨非金属性较强的是Cl,试用化学反应方程式说明Cl2+Na2S═2NaCl+S↓.
分析 由元素在周期表中位置,可知①为C、②为N、③为O、④为F、⑤为Na、⑥为Mg、⑦为Al、⑧为S、⑨为Cl、⑩为Ar.
(1)同周期自左而右非金属性增强、同主族自上而下非金属性减弱,而稀有气体性质稳定;碳元素组成有机物,形成的化合物种类最多;
(2)同周期自左而右原子半径碱性;同周期自左而右金属性减弱、同主族自上而下金属性增强,金属性越强,最高价氧化物对应水化物的碱性越强;氢氧化铝属于两性氢氧化物;
(3)同周期自左而右金属性减弱,单质的活泼性减弱;可以根据金属与水或酸反应剧烈程度、最高价氧化物对应水化物的碱性强弱验证;
(4)同周期自左而右非金属性增强,可以利用单质之间相互置换反应等进行验证.
解答 解:由元素在周期表中位置,可知①为C、②为N、③为O、④为F、⑤为Na、⑥为Mg、⑦为Al、⑧为S、⑨为Cl、⑩为Ar.
(1)同周期自左而右非金属性增强、同主族自上而下非金属性减弱,而稀有气体性质稳定,则F的非金属性最强,碳元素组成有机物,形成的化合物种类最多,
故答案为:F;C;
(2)同周期从左向右原子半径在减小,则Cl的原子半径在第三周期最小,以上元素中Na的金属性最强,则最高价氧化物对应水化物NaOH的碱性最强,Al元素的最高价氧化物对应水化物Al(OH)3的具有两性,
故答案为:Cl;NaOH;Al(OH)3;
(3)同周期从左向右金属性在减弱,则Na、Mg、Al单质的活泼性为Na>Mg>Al,可利用单质分别与水(或酸)反应的剧烈程度来验证,
故答案为:Na;Mg;Al;单质与水或酸反应的剧烈程度;
(4)同周期自左而右非金属性增强,故非金属性Cl>S,可以用单质之间相互置换反应等进行验证,反应方程式为:Cl2+Na2S═2NaCl+S↓,
故答案为:Cl;Cl2+Na2S═2NaCl+S↓.
点评 本题考查元素周期表和元素周期律综合运用,注意金属性、非金属性强弱比较实验事实,旨在考查学生对基础知识的巩固.

| A. | 同主族元素中X的气态氢化物最稳定 | |
| B. | X、Y、Z所形成的化合物只含有共价键 | |
| C. | Z的最高价氧化物对应的水化物化学式为H3ZO4 | |
| D. | X与Y可形成共价化合物 |
| R | ||
| X | Y | Z |
| A. | 原子半径大小顺序是:Y>X>R | |
| B. | 其气态氢化物的稳定性顺序是:Z>Y>X>R | |
| C. | X、Y、Z中Z的氧化物对应的水化物的酸性最强 | |
| D. | R的气态氢化物与它的含氧酸之间能发生化学反应 |
| A. |  氮气 | B. |  铜片 | C. |  浓盐酸 | D. |  浓硝酸 |
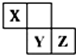 X、Y、Z三种短周期元素在周期表中的位置如图,其中Z单质可用于工业制漂白粉,下列说法不正确的是( )
X、Y、Z三种短周期元素在周期表中的位置如图,其中Z单质可用于工业制漂白粉,下列说法不正确的是( )| A. | Y的非金属性比Z的弱 | |
| B. | 三种元素均为非金属元素 | |
| C. | Z形成的气态氢化物比Y形成的气态氢化物稳定 | |
| D. | Y元素的最高正化合价比Z元素的最高正化合价高 |
| A. | 4种 | B. | 7种 | C. | 8种 | D. | 9种 |
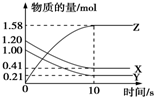 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是( )| A. | 反应开始到10 s,用Z表示的反应速率为0.158 mol•L-1•s-1 | |
| B. | 反应开始到10 s时,平均反应速率:v(X)=v(Y)=0.039 5 mol•L-1•s-1 | |
| C. | 10 s后,该反应停止进行 | |
| D. | 反应的化学方程式为2X(g)+Y(g)?2Z(g) |
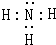 .
. →
→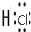 .
. 或
或 .
.