题目内容
16.已知一些共价键的键能如下(单位:kJ•mol-1)H-H 436.4 Cl-Cl 242.7 H-Cl 431.8
①写出氢气在氯气中燃烧生成氯化氢气体的热化学方程式:H2(g)+Cl2(g)=2HCl(g)△H=-184.5kJ•mol-1.
②若有1g氢气在氯气中完全燃烧,可放出热量92.25kJ.
分析 ①焓变=反应物键能总和-生成物键能总和,标注物质聚集状态和对应反应的焓变写出热化学方程式;
②1g氢气的物质的量为0.5mol,根据焓变计算.
解答 解:①反应H2(g)+Cl2(g)═2HCl(g),焓变△H=反应物键能总和-生成物键能总和=436.4kJ/mol+242.7kJ/mol-2×431.8kJ/mol=-184.5kJ/mol,
则热化学方程式为:H2(g)+Cl2(g)=2HCl(g)△H=-184.5kJ•mol-1,
故答案为:H2(g)+Cl2(g)=2HCl(g)△H=-184.5kJ•mol-1;
②根据H2(g)+Cl2(g)=2HCl(g)△H=-184.5kJ•mol-1,说明1mol氢气在氯气中完全燃烧放出184.5kJ的热量,
1g氢气在氯气中完全燃烧放出的热量为:0.5mol×184.5kJ•mol-1=92.25kJ,
故答案为:92.25.
点评 本题考查了反应过程中能量变化,焓变和键能的关系计算应用,热化学方程式书写方法,掌握基础是解题关键,题目较基础.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
7.下列反应的反应类型与CaO+H2O=Ca(OH)2反应类型相同的是( )
| A. | 碳酸钙受热分解 | B. | 铁在氯气中燃烧 | ||
| C. | 钠跟水反应 | D. | 氯化钠与硝酸银溶液反应 |
11.下列各组物质的水溶液不用其它试剂无法鉴别出来的是( )
| A. | NaOH、AlCl3 | B. | CuSO4、BaCl2 | C. | NaAlO2、HCl | D. | MgCl2、NaOH |
1.表为周期表中短周期的一部分,若R元素的最高正价和最低负价的绝对值之差为2,则说法正确的是( )
| R | ||
| X | Y | Z |
| A. | 原子半径大小顺序是:Y>X>R | |
| B. | 其气态氢化物的稳定性顺序是:Z>Y>X>R | |
| C. | X、Y、Z中Z的氧化物对应的水化物的酸性最强 | |
| D. | R的气态氢化物与它的含氧酸之间能发生化学反应 |
8.常用一些图案标示危险化学品,化学物质与其图案标识相符的是( )
| A. |  氮气 | B. |  铜片 | C. |  浓盐酸 | D. |  浓硝酸 |
5.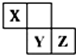 X、Y、Z三种短周期元素在周期表中的位置如图,其中Z单质可用于工业制漂白粉,下列说法不正确的是( )
X、Y、Z三种短周期元素在周期表中的位置如图,其中Z单质可用于工业制漂白粉,下列说法不正确的是( )
 X、Y、Z三种短周期元素在周期表中的位置如图,其中Z单质可用于工业制漂白粉,下列说法不正确的是( )
X、Y、Z三种短周期元素在周期表中的位置如图,其中Z单质可用于工业制漂白粉,下列说法不正确的是( )| A. | Y的非金属性比Z的弱 | |
| B. | 三种元素均为非金属元素 | |
| C. | Z形成的气态氢化物比Y形成的气态氢化物稳定 | |
| D. | Y元素的最高正化合价比Z元素的最高正化合价高 |
 .
.