题目内容
14.根据所学知识填空:(1)0.3molNH3中所含质子数与5.4gH2O分子中所含质子数相等.
(2)标准状况下,2.4g某气体的体枳为672mL,则此气体的相对分子质量为80.
(3)某盐混合溶液中含有离子:Na+、Mg2+、Cl-、SO42-,测得Na+、Mg2+和C1-的物质的量浓度依次为:0.2mol/L、0.25mol/L、0.4mol/L,测得c(SO42-)=0.15mol/L.
(4)己知离子反应:RO3n-+6I-+6H+═R-+3I2+3H2O,试根据离子方程式必须“质量守恒,电荷守恒”等判断:n=1,R元素在中RO33-的化合价是+5.
(5)同温同压下,SO2与O2的密度之比为2:1,若质量相同,两种气体的体积比为1:2.
分析 (1)依据n=$\frac{N}{{N}_{A}}$=$\frac{m}{M}$,结合氨气与水分子含有10个质子解答;
(2)依据n=$\frac{N}{{N}_{A}}$=$\frac{m}{M}$=$\frac{V}{Vm}$,摩尔质量以g/mol为单位,数值上与相对分子质量相等;
(3)依据电荷守恒规律解答;
(4)根据电荷守恒确定n值,再根据离子中正负化合价的代数和与其电荷数相等计算;
(5)同温同压下,气体密度之比等于摩尔质量之比,结合n=$\frac{N}{{N}_{A}}$=$\frac{m}{M}$=$\frac{V}{Vm}$、ρ=$\frac{M}{Vm}$进行计算.
解答 解:(1)0.3molNH3含有的质子数的物质的量为0.3mol×(7+3)=3mol,而1molH2O含有(2×1+8)mol=10mol质子,则应有0.3molH2O,质量为m(H2O)=0.3mol×18g/mol=5.4g;
故答案为:5.4g
(2)n=$\frac{6.72g}{22.4L/mol}$l=0.03mol,M=$\frac{m}{n}$=$\frac{2.4g}{0.03mol}$mol=80g/mol,则相对分子质量为80;
(3)溶液遵循电荷守恒:c(Na+)+2c(Mg2+)=c(Cl-)+2c(SO42-),
则0.2mol/L+2×0.25mol/L=0.4mol/l+2c(SO42-),
c(SO42-)=0.15mol/L,
故答案为:0.15 mol/L;
(4)离子反应:RO3 n-+6I-+6H+═R-+3I2+3H2O,根据电荷守恒知,n=1,RO3 -中R元素的化合价=-1-(-2)×3=+5,
故答案为:1;+5;
(5)根据ρ=$\frac{M}{Vm}$知,同温同压下,气体密度之比等于摩尔质量之比,所以二者密度之比=64g/mol:32g/mol=2:1;
n=$\frac{N}{{N}_{A}}$=$\frac{m}{M}$=$\frac{V}{Vm}$,可知:相同条件下,质量相等的气体,V与M成反比,所以若质量相同,两种气体的体积比为32:64=1:2;
故答案为:2:1;1:2;
点评 本题考查阿伏伽德罗定律及其推论,明确物质的量公式中各个物理量的关系即可解答,注意气体摩尔体积的适用范围及适用条件,注意密度与摩尔质量的关系.

 阅读快车系列答案
阅读快车系列答案| A. | 2molH | B. | 1mol H2O | C. | 4mol e- | D. | 0.5mol 小米 |
| A. | 标准状况下,22.4LCCl4含有NA个分子 | |
| B. | 0.1mol/L的HNO3中有0.1NA个H+ | |
| C. | 常温常压下,8gO2含有4NA个电子 | |
| D. | 1molNa被完全氧化生成Na+,失去2NA个电子 |
| A. | 大理石与醋酸反应制取二氧化碳:CaCO3+2H+═Ca2++CO2↑+H2O | |
| B. | 氯乙酸与足量氢氧化钠溶液共热:CH2ClCOOH+OH-→CH2ClCOO-+H2O | |
| C. | 用银氨溶液检验乙醛中的醛基:CH3CHO+2[Ag(NH3)2]++2OH-$\stackrel{水浴加热}{→}$CH3COO-+NH4++3NH3+2Ag↓+H2O | |
| D. | 苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O→2C6H5OH+CO${\;}_{3}^{2-}$ |
| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
②若保持温度不变,在醋酸溶液中加入一定量氨气,下列量会变小的是b(填序号)
a.c(CH3COO-) b.c(H+) c.KW d.醋酸电离平衡常数.
(2)上述提供的同浓度酸中,酸性最强的是HSCN;酸性最弱的是HCO3-;若向NaCN溶液中通入少量的CO2,发生反应的离子方程式CN-+H2O+CO2=HCN+HCO3-.
(3)CO2可用NaOH溶液吸收得到Na2CO3或NaHCO3.Na2CO3俗称纯碱,该溶液中离子浓度由大到小的顺序为c(Na+)>c(CO32-)>c(OH-)>c (HCO3-)>c(H+);同浓度的碳酸钠溶液和碳酸氢钠溶液pH较大的是Na2CO3.
| A. | 与电源正极相连的是电解槽的阴极 | |
| B. | 与电源负极相连的电极发生还原反应 | |
| C. | 在电解槽的阳极发生氧化反应 | |
| D. | 电子从电源的负极沿导线流入阴极 |
 已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用.请回答下列问题:
已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用.请回答下列问题:
 (1)已知可逆反应CO(g)+H2O(g)?CO2(g)+H2(g)△H
(1)已知可逆反应CO(g)+H2O(g)?CO2(g)+H2(g)△H
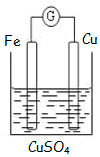 如图为牺牲阳极的阴极保护法的实验装置,此装置中Zn电极上的电极反应为Zn-2e-=Zn2+;如果将Zn换成Pt,一段时间后,在铁电极区滴入2滴黄色K3[Fe(CN)6](铁氰化钾)溶液时,烧杯中的现象是产生蓝色沉淀,发生的反应的离子方程式是3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓.
如图为牺牲阳极的阴极保护法的实验装置,此装置中Zn电极上的电极反应为Zn-2e-=Zn2+;如果将Zn换成Pt,一段时间后,在铁电极区滴入2滴黄色K3[Fe(CN)6](铁氰化钾)溶液时,烧杯中的现象是产生蓝色沉淀,发生的反应的离子方程式是3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓.