题目内容
6.下列关于电解槽的叙述中不正确的是( )| A. | 与电源正极相连的是电解槽的阴极 | |
| B. | 与电源负极相连的电极发生还原反应 | |
| C. | 在电解槽的阳极发生氧化反应 | |
| D. | 电子从电源的负极沿导线流入阴极 |
分析 A、与电源正极相连的电极是电解池的阳极;
B、与电源负极相连的电极为阴极;
C、电解池中阳极上发生失电子的氧化反应;
D、依据电解原理分析,电子从电源的负极沿导线流入电解槽的阴极,通过电解质溶液中离子定向移动发生氧化还原反应,电子在阳极流回到电源正极.
解答 解:A、与电源正极相连的是电解槽的阳极,故A错误;
B、与电源负极相连的电极为阴极,发生还原反应,故B正确;
C、电解池中阳极上发生失电子的氧化反应,故C正确;
D、电子从电源的负极沿导线流入电解槽的阴极,通过电解质溶液中离子定向移动发生氧化还原反应,电子在阳极流回到电源正极,故D正确;
故选A.
点评 本题考查了电解原理的分析应用,电极名称和电极判断是解题关键,掌握基础是解题关键,题目难度中等

练习册系列答案
相关题目
17.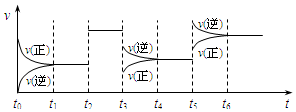 某密闭容器中发生如下反应:X(g)+3Y(g)?2Z(g);△H<0,如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是
某密闭容器中发生如下反应:X(g)+3Y(g)?2Z(g);△H<0,如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是
( )
 某密闭容器中发生如下反应:X(g)+3Y(g)?2Z(g);△H<0,如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是
某密闭容器中发生如下反应:X(g)+3Y(g)?2Z(g);△H<0,如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是( )
| A. | t2时加入了催化剂 | B. | t3时降低了温度 | ||
| C. | t5时升高了温度 | D. | t4~t5时间内转化率一定最低 |
11.下表是周期表中的一部分,根据A-I在周期表中的位置,第(1)~(4)小题用元素符号或化学式回答,(5)小题按题目要求回答.
(1)表中元素,化学性质最不活泼的是Ne,氧化性最强的单质是F2
(2)最高价氧化物的水化物碱性最强的是NaOH,酸性最强的是HClO4;
(3)A分别与D、E、F、G、H形成的化合物中,最稳定气态氢化物是HF;
(4)在B、C、F、H中,离子半径从大到小的顺序是S2->Cl->Na+>Al3+;
(5)B的最高价氧化物的水化物和C的最高价氧化物相互反应的离子方程式OH-+Al(OH)3=AlO2-+2H2O.
| 族 周期 | I A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
(2)最高价氧化物的水化物碱性最强的是NaOH,酸性最强的是HClO4;
(3)A分别与D、E、F、G、H形成的化合物中,最稳定气态氢化物是HF;
(4)在B、C、F、H中,离子半径从大到小的顺序是S2->Cl->Na+>Al3+;
(5)B的最高价氧化物的水化物和C的最高价氧化物相互反应的离子方程式OH-+Al(OH)3=AlO2-+2H2O.
18.范德华力为a kJ•mol-1,化学键为b kJ•mol-1,氢键为c kJ•mol-1,则a、b、c的大小关系是( )
| A. | b>c>a | B. | b>a>c | C. | c>b>a | D. | a>b>c |
3.某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5μm的悬浮颗粒物)其主要来源为燃煤、机动车尾气等.因此,对PM2.5、SO2、NOx等进行研究具有重要意义.请回答下列问题:
(1)对PM2.5样本用蒸馏水处理制成待测试样.若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
根据表中数据判断PM2.5的酸碱性为酸性,试样的pH值4.
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料.已知:H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8KJ/mol
C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.5KJ/mol
写出焦炭与水蒸气反应的热化学方程式C(s)+H2O(g)=CO(g)+H2(g)H=+131.3KJ/mol;
②洗涤含SO2的烟气,以下物质可作洗涤剂的是ab;
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(3)汽车尾气中NOx和CO的生成及转化为:
①已知气缸中生成NO的反应为:N2(g)+O2(g)?2NO(g)△H>0
若1mol空气含有0.8molN2和0.2molO2,1300℃时在密闭容器内反应达到平衡.测得NO为8×10-4mol.计算该温度下的平衡常数K=4×10-6;汽车启动后,气缸温度越高,单位时间内NO排放量越大,原因是因为该反应为吸热反应,温度越高,反应速率加快,平衡右移.
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:
2CO(g)=2C(s)+O2(g)已知该反应的△H>0,简述该设想能否实现的依据该反应是焓增,熵减的反应,任何温度下均不自发进行.
③目前,在汽车尾气系统中装置催化转化器可减少CO和NO的污染,其化学反应方程式为2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2.
(1)对PM2.5样本用蒸馏水处理制成待测试样.若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol.L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料.已知:H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8KJ/mol
C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.5KJ/mol
写出焦炭与水蒸气反应的热化学方程式C(s)+H2O(g)=CO(g)+H2(g)H=+131.3KJ/mol;
②洗涤含SO2的烟气,以下物质可作洗涤剂的是ab;
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(3)汽车尾气中NOx和CO的生成及转化为:
①已知气缸中生成NO的反应为:N2(g)+O2(g)?2NO(g)△H>0
若1mol空气含有0.8molN2和0.2molO2,1300℃时在密闭容器内反应达到平衡.测得NO为8×10-4mol.计算该温度下的平衡常数K=4×10-6;汽车启动后,气缸温度越高,单位时间内NO排放量越大,原因是因为该反应为吸热反应,温度越高,反应速率加快,平衡右移.
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:
2CO(g)=2C(s)+O2(g)已知该反应的△H>0,简述该设想能否实现的依据该反应是焓增,熵减的反应,任何温度下均不自发进行.
③目前,在汽车尾气系统中装置催化转化器可减少CO和NO的污染,其化学反应方程式为2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2.
4.(1)中和热测定的实验中,用到的玻璃仪器有烧杯、温度计、环形玻璃搅拌棒、量筒.
(2)量取反应物时,取50mL 0.50mol•L-1的盐酸,还需加入的试剂是B.
A.50mL 0.50mol•L-1 NaOH溶液 B.50mL 0.55mol•L-1 NaOH溶液
C.1.0g NaOH固体
(3)实验时大烧杯上若不盖硬纸板,求得的中和热数值偏小(填偏大、偏小、无影响)
(4)由甲、乙两人组成的实验小组,在同样的实验条件下,用同样的实验仪器和方法进行两组测定中和热的实验,实验试剂及其用量如表所示.
①设充分反应后溶液的比热容c=4.18J/(g•℃),忽略实验仪器的比热容及溶液体积的变化,则△H1=-56.8kJ/mol;△H2=-52.7kJ/mol.(已知溶液密度 均为1g/cm3)
②△H1≠△H2原因是NaOH是强碱,NH3•H2O是弱碱电离吸热.
(2)量取反应物时,取50mL 0.50mol•L-1的盐酸,还需加入的试剂是B.
A.50mL 0.50mol•L-1 NaOH溶液 B.50mL 0.55mol•L-1 NaOH溶液
C.1.0g NaOH固体
(3)实验时大烧杯上若不盖硬纸板,求得的中和热数值偏小(填偏大、偏小、无影响)
(4)由甲、乙两人组成的实验小组,在同样的实验条件下,用同样的实验仪器和方法进行两组测定中和热的实验,实验试剂及其用量如表所示.
| 反应物 | 起始温度t1/℃ | 终了温度t2/℃ | 中和热/kJ•mol-1 |
| A.1.0mol/L HCl溶液50mL、1.1mol/L NaOH溶液50mL | 13.0 | 19.8℃ | △H1 |
| B.1.0mol/L HCl溶液50mL、1.1mol/L NH3•H2O溶液50mL | 13.0 | 19.3℃ | △H2 |
②△H1≠△H2原因是NaOH是强碱,NH3•H2O是弱碱电离吸热.
 或
或 .
.