题目内容
9.能正确表示下列反应的离子方程式为( )| A. | CaCl2溶液中通入CO2:Ca2++CO2+H2O═CaCO3↓+2H+ | |
| B. | 酸性KMnO4溶液中通入SO2:5SO2+2MnO4-+2H2O═5SO42-+2Mn2++4H+ | |
| C. | FeBr2溶液中通入足量Cl2:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| D. | AgCl悬浊液中通HI:Ag++HI═AgI↓+H+ |
分析 A.碳酸的酸性弱于盐酸;
B.高锰酸钾具有强的氧化性,能够氧化二氧化硫生成硫酸根离子;
C.氯气足量二价铁离子、溴离子都被氧化;
D.碘化氢为强电解质,应拆成离子,氯化银为沉淀,应保留化学式.
解答 解:A.碳酸的酸性弱于盐酸,二氧化碳通入氯化钙溶液不反应,故A错误;
B.酸性KMnO4溶液中通入SO2,离子方程式:5SO2+2MnO4-+2H2O═5SO42-+2Mn2++4H+,故B正确;
C.FeBr2溶液中通入足量Cl2,离子方程式:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl-,故C错误;
D.AgCl悬浊液中通HI,离子方程式:AgCl+I-═AgI↓+Cl-,故D错误;
故选:B.
点评 本题考查了离子方程式的书写,侧重考查氧化还原反应、复分解反应的离子方程式书写,明确反应实质及离子方程式书写方法是解题关键,注意化学式的拆分,题目难度中等.

练习册系列答案
相关题目
19.甲、乙、丙、丁四种易溶于水的物质,分别由NH4+、Ba2+、Mg2+、H+、OH-、Cl-、HCO3-、SO42-中的不同阳离子和阴离子各一种组成,将甲溶液分别与其他三种物质的溶液混合,均有沉淀和气体生成,则乙、丙、丁不可能是( )
| A. | NH4Cl | B. | Mg(HCO3)2 | C. | H2SO4 | D. | MgCl2 |
20.碳酸亚乙酯是一种重要的添加剂,其结构如图( ),碳酸亚乙酯可由两种分子发生酯化反应制取,这两种分子的原子个数比为( )
),碳酸亚乙酯可由两种分子发生酯化反应制取,这两种分子的原子个数比为( )
 ),碳酸亚乙酯可由两种分子发生酯化反应制取,这两种分子的原子个数比为( )
),碳酸亚乙酯可由两种分子发生酯化反应制取,这两种分子的原子个数比为( )| A. | 3:5 | B. | 1:2 | C. | 2:3 | D. | 2:5 |
4.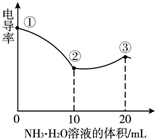 电导率可用于衡量电解质溶液导电能力大小,且电导率越大溶液的导电能力越强.室温下,用0.100mol/L的NH3•H2O 滴定10.00mL 浓度均为0.100mol/LHCl和CH3COOH的混合液,电导率曲线如右图所示.下列说法正确的是( )
电导率可用于衡量电解质溶液导电能力大小,且电导率越大溶液的导电能力越强.室温下,用0.100mol/L的NH3•H2O 滴定10.00mL 浓度均为0.100mol/LHCl和CH3COOH的混合液,电导率曲线如右图所示.下列说法正确的是( )
 电导率可用于衡量电解质溶液导电能力大小,且电导率越大溶液的导电能力越强.室温下,用0.100mol/L的NH3•H2O 滴定10.00mL 浓度均为0.100mol/LHCl和CH3COOH的混合液,电导率曲线如右图所示.下列说法正确的是( )
电导率可用于衡量电解质溶液导电能力大小,且电导率越大溶液的导电能力越强.室温下,用0.100mol/L的NH3•H2O 滴定10.00mL 浓度均为0.100mol/LHCl和CH3COOH的混合液,电导率曲线如右图所示.下列说法正确的是( )| A. | ①点溶液中c(H+)为0.200 mol/L | B. | ②点时溶液的温度最低 | ||
| C. | ③点后离子数目减少电导率略降低 | D. | ③点时溶液中有c ( Cl-)>(CH3COO-) |
14. 四种常见元素的性质或结构信息如下表,试根据信息回答有关问题.
四种常见元素的性质或结构信息如下表,试根据信息回答有关问题.
(1)A元素与其同周期相邻两种元素原子的第一电离能由大到小的顺序为N>O>C(用元素符号表示);试解释其原因同周期随原子序数增大第一电离能呈增大趋势,N元素2p轨道容纳3个电子,处于半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能由大到下的顺序为N>O>C.
(2)B元素的低价氧化物分子中心原子的杂化方式为sp2,B元素的最高价氧化物分子VSEPR模型为平面三角形,B元素与D元素形成分子空间构型为直线型.
(3)D元素最高价氧化物的熔点比同主族相邻元素最高价氧化物的熔点低(填“高”或“低”),其原因是晶体类型不同,二氧化碳形成分子晶体,二氧化硅形成原子晶体.
(4)往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,观察到的现象为先生成蓝色沉淀,后沉淀溶解生成深蓝色溶液;后一现象的化学反应方程式为Cu(OH)2+4NH3=[Cu(NH3)4](OH)2.
(5)某同学根据上述信息,推断A基态原子的核外电子排布为: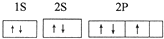
该同学所画的电子排布图违背了洪特规则.
(6)C晶体的堆积方式如图所示,设C原子半径为r cm,阿伏伽德罗常数用NA表示,则晶胞中C原子的配位数为12,C晶体的密度为$\frac{16}{\sqrt{2}{r}^{3}{N}_{A}}$g•cm-3(要求写表达式,可以不化简).
 四种常见元素的性质或结构信息如下表,试根据信息回答有关问题.
四种常见元素的性质或结构信息如下表,试根据信息回答有关问题.| 元素 | A | B | C | D |
| 性质 结构 信息 | 原子核外有两个电子层,最外层有3个未成对的电子 | 原子的M层有1对成对的p电子 | 原子核外电子排布为[Ar]3d104sx, 有+1、+2两种常见化合价 | 有两种常见氧化物,其中有一种是冶金工业常用的还原剂 |
(2)B元素的低价氧化物分子中心原子的杂化方式为sp2,B元素的最高价氧化物分子VSEPR模型为平面三角形,B元素与D元素形成分子空间构型为直线型.
(3)D元素最高价氧化物的熔点比同主族相邻元素最高价氧化物的熔点低(填“高”或“低”),其原因是晶体类型不同,二氧化碳形成分子晶体,二氧化硅形成原子晶体.
(4)往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,观察到的现象为先生成蓝色沉淀,后沉淀溶解生成深蓝色溶液;后一现象的化学反应方程式为Cu(OH)2+4NH3=[Cu(NH3)4](OH)2.
(5)某同学根据上述信息,推断A基态原子的核外电子排布为:

该同学所画的电子排布图违背了洪特规则.
(6)C晶体的堆积方式如图所示,设C原子半径为r cm,阿伏伽德罗常数用NA表示,则晶胞中C原子的配位数为12,C晶体的密度为$\frac{16}{\sqrt{2}{r}^{3}{N}_{A}}$g•cm-3(要求写表达式,可以不化简).
1.晋葛洪《抱朴子内篇•黄白》记载“曾青涂铁,铁赤色如铜”(“曾青”是指硫酸铜).下列说法不正确的是( )
| A. | 记载中的反应属于置换反应 | B. | 记载中蕴含了湿法炼铜的原理 | ||
| C. | 由记载得出铁单质是赤色(红色) | D. | 每生成1mol铜转移2mol电子 |
19.下列实验中,所选用的装置、药品及对应原理都正确的是( )
| 选项 | 目的 | 装置 | 原理 |
| A | 分离乙酸乙酯和乙醇 |  | 乙酸乙酯和乙醇的密度不同 |
| B | 实验室制备氨气 |  | 2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3+2H2O |
| C | 证明非金属性N>C>Si |  | 最高价含氧酸酸性:硝酸>碳酸>硅酸 |
| D | 除去丁醇中的乙醚 |  | 丁醇和乙醚的沸点不同 |
| A. | A | B. | B | C. | C | D. | D |


 .
. .
. 等.(任写一种)
等.(任写一种)