题目内容
金属镍及其化合物在合金材料以及催化剂等方面应用广泛.

(1)基态Ni原子的价电子(外围电子)排布式为 ;
(2)金属镍能与CO形成配合物Ni(CO)4,写出与CO互为等电子体的一种分子和一种离子的化学式 、 ;
(3)很多不饱和有机物在Ni催化下可与H2发生加成反应.如①CH2=CH2、②HC≡CH、③ 、④HCHO其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子的立体结构为 形;
、④HCHO其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子的立体结构为 形;
(4)Ni2+和Fe2+的半径分别为69pm和78pm,则熔点NiO FeO(填“<”或“>”);
(5)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如图1所示.该合金的化学式为 ;
(6)NiO晶体结构与NaCl晶体类似,其晶胞的棱长为a cm,则该晶体中距离最近的两个阳离子核间的距离为 cm(用含有a的代数式表示).在一定温度下NiO晶体可以自发地分散并形成“单分子层”(如图2),可以认为氧离子作密置单层排列,镍离子填充其中,列式并计算每平方米面积上分散的该晶体的质量 g/m2(氧离子的半径为1.40×10-10m,结果保留两位有效数字)

(1)基态Ni原子的价电子(外围电子)排布式为
(2)金属镍能与CO形成配合物Ni(CO)4,写出与CO互为等电子体的一种分子和一种离子的化学式
(3)很多不饱和有机物在Ni催化下可与H2发生加成反应.如①CH2=CH2、②HC≡CH、③
 、④HCHO其中碳原子采取sp2杂化的分子有
、④HCHO其中碳原子采取sp2杂化的分子有(4)Ni2+和Fe2+的半径分别为69pm和78pm,则熔点NiO
(5)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如图1所示.该合金的化学式为
(6)NiO晶体结构与NaCl晶体类似,其晶胞的棱长为a cm,则该晶体中距离最近的两个阳离子核间的距离为
考点:原子核外电子排布,配合物的成键情况,晶胞的计算,原子轨道杂化方式及杂化类型判断
专题:化学键与晶体结构
分析:(1)先写出基态原子核外电子排布式,再写出价电子排布式;
(2)等电子体中原子数相同、价电子数相同;
(3)根据碳原子含有的σ键和孤电子对判断碳原子采取的杂化方式; 根据价层电子对互斥理论判断甲醛的空间构型;
(4)影响离子晶体熔点的因素有离子半径和电荷;
(5)利用均摊法计算晶胞中含有的原子数;
(6)根据氯化钠的结构知,氧离子和相邻的镍离子之间的距离为
,距离最近的两个阳离子核间的距离是距离最近的氧离子和镍离子距离的
倍,根据图片知,每个氧化镍所占的面积=2×1.40×10-10m×2×1.40×10-10m×sin60°,每个氧化镍的质量为
g,每个氧化镍的质量乘以每平方米含有的氧化镍个数就是每平方米含有的氧化镍质量.
(2)等电子体中原子数相同、价电子数相同;
(3)根据碳原子含有的σ键和孤电子对判断碳原子采取的杂化方式; 根据价层电子对互斥理论判断甲醛的空间构型;
(4)影响离子晶体熔点的因素有离子半径和电荷;
(5)利用均摊法计算晶胞中含有的原子数;
(6)根据氯化钠的结构知,氧离子和相邻的镍离子之间的距离为
| a |
| 2 |
| 2 |
| 74.7 |
| NA |
解答:
解:(1)核外电子排布为[Ar]3d84s2,则价电子排布式是3d84s2,故答案为:3d84s2;
(2)CO含有2个原子14个电子,所以CO互为等电子体的一种分子和一种离子的化学式为:N2、CN-(或O22+、C22-、NO+),故答案为:N2;CN-;
(3)①CH2=CH2中每个碳原子含有3个σ键,不含孤电子对,所以采取sp2杂化,故正确;
②HC≡CH中每个碳原子含有2个σ键,不含孤电子对,所以采取sp杂化,故错误;
③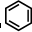 中每个碳原子含有3个σ键,不含孤电子对,所以采取sp2杂化,故正确;
中每个碳原子含有3个σ键,不含孤电子对,所以采取sp2杂化,故正确;
④HCHO中碳原子含有3个σ键,不含孤电子对,所以采取sp2杂化,故正确;
HCHO中碳原子含有3个σ键,不含孤电子对,所以其空间构型是平面三角形;
故答案为:①③④; 平面三角;
(4)影响离子晶体熔点的因素有离子半径和电荷,相同电荷时,离子半径越小,熔点越高,镍离子半径小于亚铁离子半径,所以氧化镍熔点高于氧化亚铁熔点,
故答案为:>;
(5)该晶胞中含La原子个数=8×
=1,含有Ni=1+8×
=5,所以其化学式为LaNi5或Ni5La,故答案为:LaNi5或Ni5La;
(6)根据氯化钠的结构知,氧离子和相邻的镍离子之间的距离为
,距离最近的两个阳离子核间的距离是距离最近的氧离子和镍离子距离的
倍,所以其距离
acm,由图可知,每个氧化镍所占的面积=2×1.40×10-10m×2×1.40×10-10m×sin60°,则每平方米含有的氧化镍个数=
,每个氧化镍的质量为
g,
所以每平方米含有的氧化镍质量=
g×
=
=1.8×10-3,
故答案为:
a;
=1.8×10-3.
(2)CO含有2个原子14个电子,所以CO互为等电子体的一种分子和一种离子的化学式为:N2、CN-(或O22+、C22-、NO+),故答案为:N2;CN-;
(3)①CH2=CH2中每个碳原子含有3个σ键,不含孤电子对,所以采取sp2杂化,故正确;
②HC≡CH中每个碳原子含有2个σ键,不含孤电子对,所以采取sp杂化,故错误;
③
 中每个碳原子含有3个σ键,不含孤电子对,所以采取sp2杂化,故正确;
中每个碳原子含有3个σ键,不含孤电子对,所以采取sp2杂化,故正确;④HCHO中碳原子含有3个σ键,不含孤电子对,所以采取sp2杂化,故正确;
HCHO中碳原子含有3个σ键,不含孤电子对,所以其空间构型是平面三角形;
故答案为:①③④; 平面三角;
(4)影响离子晶体熔点的因素有离子半径和电荷,相同电荷时,离子半径越小,熔点越高,镍离子半径小于亚铁离子半径,所以氧化镍熔点高于氧化亚铁熔点,
故答案为:>;
(5)该晶胞中含La原子个数=8×
| 1 |
| 8 |
| 1 |
| 2 |
(6)根据氯化钠的结构知,氧离子和相邻的镍离子之间的距离为
| a |
| 2 |
| 2 |
| ||
| 2 |
| 1 |
| (2×1.40×10 -10) 2sin60° |
| 74.7 |
| NA |
所以每平方米含有的氧化镍质量=
| 74.7 |
| NA |
| 1 |
| (2×1.40×10 -10) 2sin60° |
| 74.7 |
| 6.02×1023×(2×1.40×10-10)2Sin600 |
故答案为:
| ||
| 2 |
| 74.7 |
| 6.02×1023×(2×1.40×10-10)2Sin600 |
点评:本题考查了配合物的成键情况、价电子的排布式等知识点,难度不大,明确配位键是由提供孤电子对的原子指向提供空轨道的原子,计算是物质结构晶体部分的难点.

练习册系列答案
相关题目
已知:2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ?mol-1
H2(g)+
O2(g)═H2O(l)△H=-285.8kJ?mol-1
由此可知,在等温下蒸发36g液态水需吸收的热量( )
H2(g)+
| 1 |
| 2 |
由此可知,在等温下蒸发36g液态水需吸收的热量( )
| A、483.6 kJ |
| B、88 kJ |
| C、285.8 kJ |
| D、44 kJ |
分子式为C4H8O2,既能发生银镜反应,又能与金属钠反应的有机物有(不考虑立体异构)( )
| A、4种 | B、5种 | C、6种 | D、7种 |
2003年2月1日,美国哥伦比亚号航天飞机在返回地面的途中坠毁,举世震惊,尽管科学家在探索太空的过程中遇到了挫折,但这决不会阻止人类对太空科学探究的步伐.该航天飞机用铝粉和高氯酸铵(NH4ClO4)的混合物作固体燃料,点燃时,铝粉氧化放热引发高氯酸铵反应,其化学方程式可表示为:2NH4ClO4=N2↑+Cl2↑+2O2↑+4H2O.下列对此反应的叙述中不正确的是( )
| A、上述反应瞬间产生大量高温气体推动飞机飞行 |
| B、该反应既是氧化还原反应也是分解反应 |
| C、上述反应过程中,旧化学键断裂所吸收的能量大于新化学键形成所释放的能量 |
| D、反应从能量变化上说,主要是化学能转变为热能和动能 |
化学与科学、技术、社会、环境密切相关.下列说法不正确的是( )
| A、用二氧化碳和环氧丙烷生产可降解高聚物有利于环境和生态 |
| B、高温能杀死流感病毒是因为构成病毒的蛋白质受热变性 |
| C、光导纤维的主要成分不是二氧化硅而是单晶硅 |
| D、人体摄入油脂,在体内水解可得到高级脂肪酸和甘油 |



 如图所示的原电池装置
如图所示的原电池装置