题目内容
写出下列反应的热化学方程式:
(1)10g乙烷(C2H6)气体完全燃烧生成液态水放出热量520kJ.
(2)10gCaCO3高温分解吸收热量17.56kJ. .
(1)10g乙烷(C2H6)气体完全燃烧生成液态水放出热量520kJ.
(2)10gCaCO3高温分解吸收热量17.56kJ.
考点:热化学方程式
专题:化学反应中的能量变化
分析:(1)10g乙烷(C2H6)气体完全燃烧生成液态水放出热量520kJ,计算2mol乙烷完全燃烧放出热量=
=3120kJ,依据热化学方程式的书写标注物质聚集状态和对应焓变得到;
(2)10gCaCO3高温分解吸收热量17.56kJ,计算1mol碳酸钙吸热=
=175.6kJ,依据热化学方程式的书写标注物质聚集状态和对应焓变得到;
| 529KJ×2mol | ||
|
(2)10gCaCO3高温分解吸收热量17.56kJ,计算1mol碳酸钙吸热=
| 1mol×17.56KJ | ||
|
解答:
解:(1)10g乙烷(C2H6)气体完全燃烧生成液态水放出热量520kJ,计算2mol乙烷完全燃烧放出热量=
=3120kJ,反应的热化学方程式为:
2C2H6(g)+7O2 (g)=4CO2(g)+6H20(l);△H=-3120kJ/mol;
故答案为:2C2H6(g)+7O2 (g)=4CO2(g)+6H20(l);△H=-3120kJ/mol;
(2)10gCaCO3高温分解吸收热量17.56kJ,计算1mol碳酸钙吸热=
=175.6kJ,反应的热化学方程式为:CaCO3(s)=CaO(s)+CO2(g);△H=+175.6kJ/mol;
故答案为:CaCO3(s)=CaO(s)+CO2(g);△H=+175.6kJ/mol.
| 529KJ×2mol | ||
|
2C2H6(g)+7O2 (g)=4CO2(g)+6H20(l);△H=-3120kJ/mol;
故答案为:2C2H6(g)+7O2 (g)=4CO2(g)+6H20(l);△H=-3120kJ/mol;
(2)10gCaCO3高温分解吸收热量17.56kJ,计算1mol碳酸钙吸热=
| 1mol×17.56kJ | ||
|
故答案为:CaCO3(s)=CaO(s)+CO2(g);△H=+175.6kJ/mol.
点评:本题考查了热化学方程式的书写方法和注意问题,注意反应焓变的计算应用,题目较简单.

练习册系列答案
 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案
相关题目
在纯水中加入物质的量相等的Ag+、Pb2+、Na+、NO3-、SO42-、Cl-,再用惰性电极电解此溶液,并收集两极电解产物,则所得氧化产物与还原产物的质量比最接近于( )
| A、8:1 |
| B、108:35.5 |
| C、35.5:108 |
| D、16:207 |
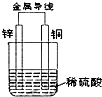 如图所示,将锌片和铜片通过导线相连,置于稀硫酸中.下列说法正确的是( )
如图所示,将锌片和铜片通过导线相连,置于稀硫酸中.下列说法正确的是( )| A、能将电能转换为化学能 |
| B、溶液会逐渐变为蓝色 |
| C、锌片是负极,发生氧化反应 |
| D、外电路中电子由铜片经导线流向锌片 |

 、④HCHO其中碳原子采取sp2杂化的分子有
、④HCHO其中碳原子采取sp2杂化的分子有 有两个起始体积相同的密闭容器A和B,A容器为固定体积;B容器有一个可移动的活塞,能使容器内保持恒压.起始时这两个容器分别充入等量的SO3气体,并使A、B容器中气体体积相等,并保持在400℃条件下发生反应2SO3?2SO2+O2,并达到平衡.
有两个起始体积相同的密闭容器A和B,A容器为固定体积;B容器有一个可移动的活塞,能使容器内保持恒压.起始时这两个容器分别充入等量的SO3气体,并使A、B容器中气体体积相等,并保持在400℃条件下发生反应2SO3?2SO2+O2,并达到平衡. 已知25℃时部分弱电解质的电离平衡常数数据如表所示:
已知25℃时部分弱电解质的电离平衡常数数据如表所示: