题目内容
2.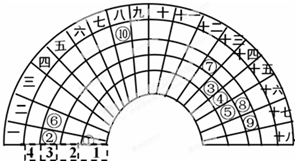 元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法不正确的是( )
元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法不正确的是( )| A. | ⑥、⑧、⑨对应原子的半径依次减小 | |
| B. | ②、⑦的最高价氧化物对应的水化物能相互反应 | |
| C. | 元素⑩处于常见周期表第四周期第VIIIB族 | |
| D. | ①分别与③、④、⑤形成的气态化合物稳定性大小为:⑤>④>③ |
分析 由元素在周期表中的位置可知,①为H、②为Na、③为C、④为N、⑤为O、⑥为Mg、⑦为Al、⑧为S、⑨为Cl、⑩为Fe.
A.同周期随原子序数增大,原子半径减小;
B.②、⑦的最高价氧化物对应的水化物分别为NaOH、Al(OH)3,二者反应生成偏铝酸钠与水;
C.元素⑩处于常见周期表第四周期第VⅢ族;
D.非金属性越强,对应氢化物越稳定.
解答 解:由元素在周期表中的位置可知,①为H、②为Na、③为C、④为N、⑤为O、⑥为Mg、⑦为Al、⑧为S、⑨为Cl、⑩为Fe,
A.同周期随原子序数增大,原子半径减小,故原子半径:⑥>⑧>⑨,故A正确;
B.②、⑦的最高价氧化物对应的水化物分别为NaOH、Al(OH)3,二者反应生成偏铝酸钠与水,故B正确;
C.元素⑩处于常见周期表第四周期第VⅢ族,不属于副族元素,故C错误;
D.非金属性⑤>④>③,非金属性越强,对应氢化物越稳定,故D正确,
故选:C.
点评 本题考查元素周期表与元素周期律,注意对元素周期律的理解掌握,难度不大.

练习册系列答案
相关题目
7.纯碱和小苏打是厨房中两种常见的用品,它们都是白色固体.下列区分这两种物质的方法正确的是( )
| A. | 等质量的碳酸钠和碳酸氢钠分别与足量的盐酸反应,前者产生二氧化碳少 | |
| B. | 用洁净铁丝蘸取两种样品在酒精灯火焰上灼烧,火焰颜色呈黄色的是小苏打 | |
| C. | 分别用炒锅加热两种样品,全部分解挥发,没有残留物的是小苏打 | |
| D. | 先将两样品配成溶液,后分别加入石灰水,无白色沉淀生成的是小苏打 |
8.根据下图海水综合利用的工业流程图,判断下列说法正确的是
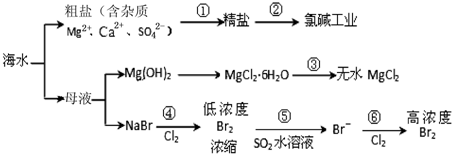
已知:MgCl2•6H2O受热生成Mg(OH)Cl和HCl气体等( )

已知:MgCl2•6H2O受热生成Mg(OH)Cl和HCl气体等( )
| A. | 除去粗盐中杂质(Mg2+、Ca2+、SO42-),加入的药品顺序为:NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸 | |
| B. | 在过程③中将MgCl2•6H2O灼烧即可制得无水MgCl2 | |
| C. | 在过程④、⑥反应中每氧化0.2 mol Br- 需消耗2.24 L Cl2 | |
| D. | 从第④步到第⑥步的目的是为了浓缩富集溴 |
5.分子式为C5H12O的醇与C4H8O2的羧酸在浓H2SO4存在时共热生成的酯有( )
| A. | 6种 | B. | 16种 | C. | 32种 | D. | 12种 |
12.32gO2和32gO3比较,下列说法正确的是( )
| A. | 两种气体所含分子数之比为1:1 | |
| B. | 两种气体的摩尔质量之比为1:1 | |
| C. | 两种气体所含原子数之比为1:1 | |
| D. | 两种气体所含的氧原子的摩尔质量之比为2:3 |
11.短周期元素X、Y、Z、W在周期表中的相对位置如右图所示,已知它们的最外层电子数之和为21,下列说法错误的是( )


| A. | 原子半径由大到小的顺序:X、Y、Z、W | |
| B. | 元素最高正价由低到高的顺序:X、Y、Z、W | |
| C. | 简单氢化物的热稳定性由弱到强的顺序:Y、Z、W | |
| D. | 最高价氧化物的水化物的酸性由弱到强的顺序:X、Y、Z |
12.下列实验操作中错误的是( )
| A. | 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 | |
| B. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 | |
| C. | 蒸发结晶时应将溶液蒸干 | |
| D. | 称量时,称量物放在称量纸上,置于托盘天平的左盘,砝码放在托盘天平的右盘中 |