题目内容
12.32gO2和32gO3比较,下列说法正确的是( )| A. | 两种气体所含分子数之比为1:1 | |
| B. | 两种气体的摩尔质量之比为1:1 | |
| C. | 两种气体所含原子数之比为1:1 | |
| D. | 两种气体所含的氧原子的摩尔质量之比为2:3 |
分析 由n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$并结合分子的构成来解答.
解答 解:n(O2)=$\frac{m}{M}$=$\frac{32g}{32g/mol}$=1mol,n(O3)=$\frac{m}{M}$=$\frac{32g}{48g/mol}$=$\frac{2}{3}$mol,
A、根据以上分析可知分子数不同,分子数之比为3:2,故A错误;
B、两种气体的摩尔质量之比为32:48=2:3,故B错误;
C、32gO2和32gO3,质量相等氧原子的数目相等,故C正确;
D、两种气体所含的氧原子的摩尔质量之比为1:1,故D错误;
故选C.
点评 本题考查了物质的量的有关计算,侧重于基本公式的应用,题目难度不大.

练习册系列答案
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案
相关题目
2.下列说法不正确的是( )
| A. | 金属钠着火时,用细沙覆盖灭火 | |
| B. | 金属钠与氧气反应,条件不同,产物不同 | |
| C. | Na的化学性质比镁活泼,故用Na与MgCl2溶液反应制取金属镁 | |
| D. | 9.2g金属钠与足量水反应,反应过程中有0.4mol电子转移 |
3.设NA为阿伏加德罗常数,下列叙述正确的是( )
| A. | 0.1 mol•L-1CaCl2溶液中含氯离子数为0.2 NA | |
| B. | 0.1 mol铁粉与过量的氯气完全反应,转移电子数为0.2NA | |
| C. | 标准状况下,2.24 L H2O所含的原子总数为0.3 NA | |
| D. | 常温常压下,17g NH3含有的电子个数为10NA |
7.用NA 表示阿伏加德罗常数的值( )
| A. | 0.2molNa2O2 完全与水反应转移的电子数为0.4NA | |
| B. | 800mL 2mol•L-1酒精溶液中所含分子数为0.6NA | |
| C. | 常温常压下,1.6g O2和O3的混合气体所含电子书为0.8NA | |
| D. | 在常温常压下,2.24L NO2与O2混合气体中所含氧原子数为0.2NA |
2.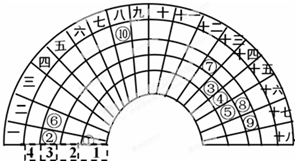 元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法不正确的是( )
元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法不正确的是( )
 元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法不正确的是( )
元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法不正确的是( )| A. | ⑥、⑧、⑨对应原子的半径依次减小 | |
| B. | ②、⑦的最高价氧化物对应的水化物能相互反应 | |
| C. | 元素⑩处于常见周期表第四周期第VIIIB族 | |
| D. | ①分别与③、④、⑤形成的气态化合物稳定性大小为:⑤>④>③ |
9.氯气及其化合物在生产和生活中有重要应用,下列关于氯及其化合物的说法正确的是( )
| A. | NaClO是“84消毒液”的有效成分,其水溶液能使有色布条褪色,反应中NaClO表现还原性 | |
| B. | Cl2与烧碱溶液反应的实质是Cl2+OH-═Cl-+ClO-+H2O | |
| C. | 氯气有毒,在通风橱中制备氯气可以消除氯气的污染 | |
| D. | 将Cl2通入淀粉-KI溶液,溶液变蓝色 |
6.如表列出的有关表述中不准确的是( )
| 序号 | A | B | C | D |
| 物质类型 | 离子化合物 | 共价键直接构成的物质 | 共价分子 | 稀有气体 |
| 代表物质 | NaCl | 金刚石 | 干冰 | Ne |
| 组成晶体的结构微粒 | Na+、Cl- | C | CO2 | Ne |
| 结构微粒间相互作用 | 离子键 | 共价键 | 分子间作用力 | 共价键 |
| A. | A | B. | B | C. | C | D. | D |
7.下列离子方程式中正确的是( )
| A. | 铜与热的稀硫酸:Cu+2H+═Cu2++H2↑ | |
| B. | 在碳酸氢铵稀溶液中加入足量的氢氧化钠稀溶液:NH4++OH-═NH3•H2O | |
| C. | AlCl3溶液滴加过量的氨水:3NH3•H2O+Al3+═Al(OH)3↓+3NH4+ | |
| D. | 氯化亚铁溶液中通入氯气:Fe2++Cl2═Fe3++2Cl- |
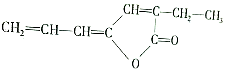 ,该物质在现代工业合成中大有用途,请回答下列有关该物质的问题:
,该物质在现代工业合成中大有用途,请回答下列有关该物质的问题: