题目内容
14.有A、B、C、D四种化合物,分别由NH4+、Ba2+、SO32-、SO42-、HCO3-、OH-中的两种组成,它们具有下列性质:①A不溶于水和盐酸; ②B不溶于水,但溶于盐酸,
③C溶于水,溶液呈碱性,与H2SO4反应生成A
④D的溶液和C的溶液混合加热既有沉淀又有气体生成,而且生成沉淀溶于盐酸,产生无色无味的气体.
试回答以下问题:
(1)推断A-D的化学式:ABaSO4;DNH4HCO3;
(2)有关反应的离子方程式.
①B与盐酸反应BaSO3+2H+=Ba2++H2O+CO2↑
③D与过量的C溶液混合加热:NH4 ++HCO3-+Ba2++2OH-=BaCO3↓+2H2O+NH3↑.
分析 有A、B、C、D四种化合物,分别由NH4+、Ba2+、SO42-、HCO3-、OH-中的两种组成,它们具有下列性质:
①A不溶于水和盐酸,说明是A是BaSO4沉淀;
②B不溶于水,但溶于盐酸,说明B沉淀为BaSO3;
③C溶于水,溶液呈碱性,与H2SO4反应生成A是BaSO4沉淀,证明C为Ba(OH)2;
④D的溶液和C的溶液混合加热既有沉淀又有气体生成,说明是铵盐,而且生成沉淀溶于盐酸,产生无色无味的气体,说明沉淀为BaCO3,则D为NH4HCO3 .
解答 解:有A、B、C、D四种化合物,分别由NH4+、Ba2+、SO42-、HCO3-、OH-中的两种组成,它们具有下列性质:
①A不溶于水和盐酸,说明是A是BaSO4沉淀;
②B不溶于水,但溶于盐酸,说明B沉淀为BaSO3;
③C溶于水,溶液呈碱性,与H2SO4反应生成A是BaSO4沉淀,证明C为Ba(OH)2;
④D的溶液和C的溶液混合加热既有沉淀又有气体生成,说明是铵盐,而且生成沉淀溶于盐酸,产生无色无味的气体,说明沉淀为BaCO3,则D为NH4HCO3 ;
推断得到A为BaSO4,B为BaSO3,C为Ba(OH)2,D为NH4HCO3 ,
(1)上述推断可知A为BaSO4,D为NH4HCO3 ,
故答案为:BaSO4,NH4HCO3 ,
(2)①B为BaSO3与盐酸反应生成氯化钡、二氧化碳和水,反应的离子方程式为:BaSO3+2H+=Ba2++H2O+CO2↑,
故答案为:BaSO3+2H+=Ba2++H2O+CO2↑;
②D与过量的C溶液混合加热生成碳酸钡,氨气和水,碳酸氢铵全部反应,反应的离子方程式为:NH4 ++HCO3-+Ba2++2OH-=BaCO3↓+2H2O+NH3↑,
故答案为:NH4 ++HCO3-+Ba2++2OH-=BaCO3↓+2H2O+NH3↑.
点评 本题考查了物质推断,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把你我物质性质和反应现象的分析判断,物质检验实验方法分析,实验过程中反应现象的理解应用,物质和离子性质熟练掌握是解题关键,题目难度中等.

 考前必练系列答案
考前必练系列答案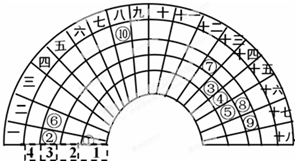 元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法不正确的是( )
元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法不正确的是( )| A. | ⑥、⑧、⑨对应原子的半径依次减小 | |
| B. | ②、⑦的最高价氧化物对应的水化物能相互反应 | |
| C. | 元素⑩处于常见周期表第四周期第VIIIB族 | |
| D. | ①分别与③、④、⑤形成的气态化合物稳定性大小为:⑤>④>③ |
| A. | NaClO是“84消毒液”的有效成分,其水溶液能使有色布条褪色,反应中NaClO表现还原性 | |
| B. | Cl2与烧碱溶液反应的实质是Cl2+OH-═Cl-+ClO-+H2O | |
| C. | 氯气有毒,在通风橱中制备氯气可以消除氯气的污染 | |
| D. | 将Cl2通入淀粉-KI溶液,溶液变蓝色 |
| 序号 | A | B | C | D |
| 物质类型 | 离子化合物 | 共价键直接构成的物质 | 共价分子 | 稀有气体 |
| 代表物质 | NaCl | 金刚石 | 干冰 | Ne |
| 组成晶体的结构微粒 | Na+、Cl- | C | CO2 | Ne |
| 结构微粒间相互作用 | 离子键 | 共价键 | 分子间作用力 | 共价键 |
| A. | A | B. | B | C. | C | D. | D |
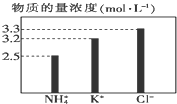
| A. | $\frac{16n}{3m-2n}$ | B. | $\frac{32n}{n-m}$ | C. | $\frac{32m}{3n-2m}$ | D. | $\frac{32n}{3n-2m}$ |
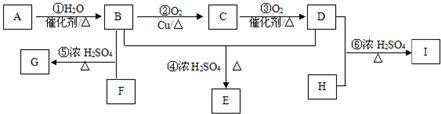
| A. | 2、64、24 | B. | 64、2、24 | C. | 64、24、2 | D. | 16、2、24 |
 .
.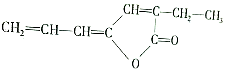 ,该物质在现代工业合成中大有用途,请回答下列有关该物质的问题:
,该物质在现代工业合成中大有用途,请回答下列有关该物质的问题: