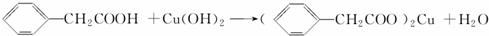题目内容
9.用KMnO4氧化溶质质量分数为36.5%的盐酸.反应方程式如下:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O①此反应中氧化剂是KMnO4,氧化产物Cl2.
②15.8g KMnO4完全反应,产生的Cl2在标准状况下的体积为5.6L,有0.5mol HCl被氧化.
③若此盐酸的密度为1.2g/cm3,其物质的量浓度为12mol/L.
分析 (1)化合价降低的元素所在的反应物是氧化剂,还原剂对应的产物是氧化产物;
(2)根据反应转移的电子数、消耗和生成的各个物质的量的知识来计算;
(3)根据物质的量浓度和密度之间的计算公式来计算.
解答 解:(1)反应中锰元素化合价降低,锰元素所在的反应物KMnO4是氧化剂,氯化氢是还原剂,则氯气为氧化产物,故答案为:KMnO4;Cl2;
(2)高锰酸钾的量、氯气的量以及消耗的盐酸之间的关系为:2KMnO4~5Cl2~16HCl,被氧化的盐酸和参加反应的盐酸的量之比为:$\frac{10}{16}$,15.8g (即0.1mol)KMnO4完全反应时,产生的Cl2为0.25mol,在标准状况下的体积为0.25mol×22.4L/mol=5.6L,消耗的HCl为0.8mol,被氧化的HCl为0.5mol,
故答案为:5.6L;0.5;
(3)根据物质的量浓度和密度之间的计算公式c=$\frac{1000ρω}{M}$=$\frac{1000×1.2g/mL×36.5%}{36.5}$=12mol/L,故答案为:12mol/L.
点评 本题氧化还原反应的相关计算,为高频考点,侧重于学生的分析、计算能力的考查,题目难度不大,解答本题注意把握元素化合价的变化,根据方程式计算.

练习册系列答案
相关题目
20.已知断开或形成1mol化学键吸收或放出的能量称为化学键的键能,如H-H键的键能为436kJ•mol-1,N≡N键的键能为945kJ•mol-1,N-H键的键能为391kJ•mol-1.则下列有关工业合成氨反应的热化学方程式正确的是
( )
( )
| A. | N2(g)+3H2(g) $?_{高温高压}^{催化剂}$2NH3(g)△H=-93 kJ•mol-1 | |
| B. | N2(g)+3H2(g) $?_{高温高压}^{催化剂}$2NH3(g)△H=+1471 kJ•mol-1 | |
| C. | N2(g)+3H2(g) $?_{高温高压}^{催化剂}$2NH3(g)△H=+93 kJ•mol-1 | |
| D. | N2(g)+3H2(g) $?_{高温高压}^{催化剂}$2NH3(g)△H=-1471 kJ•mol-1 |
17.将新制氯水注入KI溶液中充分反应后,再加CCl4,振荡后静置,看到的现象是( )
| A. | 液体均一,呈紫红色 | |
| B. | 液体分两层,上层为紫红色,下层为无色 | |
| C. | 液体分两层,上层为无色,下层为紫红色 | |
| D. | 液体均一,呈无色 |
1.(Ⅰ)在一个容积固定不变的密闭容器中进行反应:2X(g)+Y(g)?2Z(g),已知将2molX和1molY充入该容器中,反应在绝热条件下达到平衡时,Z的物质的量为pmol.回答下列问题:
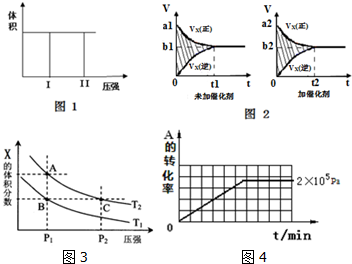
(1)若把2molX和1molY充入该容器时,处于状态I,达到平衡时处于状态II(如图1),则该反应的△H< 0; 熵变△S<0 ( 填:“<,>,=”).该反应在低温(填:高温或低温)条件下能自发进行.
(2)该反应的v-t图象如图2中左图所示.若其他条件不变,仅在反应前加入合适的催化剂,则其v-t图象如图2中右图所示.以下说法正确的是②③⑤
①a1>a2 ②b1<b2 ③t1>t2 ④图2中阴影部分面积更大⑤两图中阴影部分面积相等
(3)若该反应在容积可变的密闭容器中发生,在温度为T1、T2时,平衡体系中X的体积分数随压强变化曲线如图3所示.下列说法正确的是BD.
A. A、C两点的反应速率:A>C
B. A、C两点的气体密度:A<C
C. B、C两点的气体的平均相对分子质量:B<C
D. 由状态B到状态A,可以用加热的方法
(Ⅱ)在容积可变的密闭容器中发生反应:mA(g)+nB(g)?pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表
(1)当压强从2×105 Pa增加到5×105 Pa时,平衡不移动(填:向左,向右,不)
(2)维持压强为2×105 Pa,当反应达到平衡状态时,体系中共有amol气体,再向体系中加入bmolB,当重新达到平衡时,体系中气体总物质的量是a+bmol.
(3)当压强为1×106 Pa时,此反应的平衡常数表达式:K=$\frac{c(C){\;}^{p}}{c(A){\;}^{m}}$.
(4)其他条件相同时,在上述三个压强下分别发生该反应.2×105 Pa时,A的转化率随时间变化如图4,请在图中补充画出压强分别为5×105 Pa 和1×106 Pa时,A的转化率随时间的变化曲线(请在图线上标出压强).

(1)若把2molX和1molY充入该容器时,处于状态I,达到平衡时处于状态II(如图1),则该反应的△H< 0; 熵变△S<0 ( 填:“<,>,=”).该反应在低温(填:高温或低温)条件下能自发进行.
(2)该反应的v-t图象如图2中左图所示.若其他条件不变,仅在反应前加入合适的催化剂,则其v-t图象如图2中右图所示.以下说法正确的是②③⑤
①a1>a2 ②b1<b2 ③t1>t2 ④图2中阴影部分面积更大⑤两图中阴影部分面积相等
(3)若该反应在容积可变的密闭容器中发生,在温度为T1、T2时,平衡体系中X的体积分数随压强变化曲线如图3所示.下列说法正确的是BD.
A. A、C两点的反应速率:A>C
B. A、C两点的气体密度:A<C
C. B、C两点的气体的平均相对分子质量:B<C
D. 由状态B到状态A,可以用加热的方法
(Ⅱ)在容积可变的密闭容器中发生反应:mA(g)+nB(g)?pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表
| 压强p/Pa | 2×105 | 5×105 | 1×106 |
| c(A)/mol•L-1 | 0.08 | 0.20 | 0.44 |
(2)维持压强为2×105 Pa,当反应达到平衡状态时,体系中共有amol气体,再向体系中加入bmolB,当重新达到平衡时,体系中气体总物质的量是a+bmol.
(3)当压强为1×106 Pa时,此反应的平衡常数表达式:K=$\frac{c(C){\;}^{p}}{c(A){\;}^{m}}$.
(4)其他条件相同时,在上述三个压强下分别发生该反应.2×105 Pa时,A的转化率随时间变化如图4,请在图中补充画出压强分别为5×105 Pa 和1×106 Pa时,A的转化率随时间的变化曲线(请在图线上标出压强).
18.平衡常数的大小可以表示反应进行的程度,平衡常数越大,说明( )
| A. | 反应物平衡浓度较大 | B. | 反应越有利于往逆反应方向进行 | ||
| C. | 反应进行的越彻底 | D. | 生成物平衡浓度较小 |
19.怎样用化学方法除去下列物质中混有的少量杂质,写出除杂需加入的试剂以及发生反应的离子方程式.
学法题:归纳总结除杂试剂选择的方法所选试剂能够除去杂质,且不能引进新的杂质.
| 需加入的除杂试剂 | 发生反应的离子方程式 | |
| ①CO2气体中混有HCl杂质 | 饱和NaHCO3溶液 | H++HCO3-=H2O+CO2↑ |
| ②NaHCO3溶液中混有Na2CO3 | 足量CO2 | CO32-+H2O+CO2=HCO3- |
| ③FeCl2溶液中混有FeCl3杂质 | 铁粉 | Fe+2Fe3+=3Fe2+ |
| ④Fe2O3固体中混有Al2O3杂质 | NaOH溶液 | Al2O3+2OH-=AlO2-+2H2O |
 苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线:
苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线: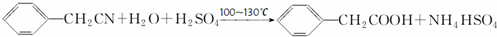 ;
;