题目内容
14.铍作为一种新兴材料日益被重视,铍是原子能、火箭、导弹,航空、宇宙航行以及冶金工业中不可缺少的宝贵材料.(1)13Be2+的中子数为9,其结构示意图为
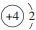 .
.(2)铍在氧气中燃烧,得到白色粉未状的氧化铍BeO,BeO的熔点为2803K,难溶于水,其熔融物难电离,化合物BeO的化学键类型为共价键(填“共价键”或“离子键”).
(3)铍既能溶于酸也能溶于碱,与碱反应生成BeO22-.写出铍与NaOH溶液反应的离子方程式:Be+2OH-=BeO22-+H2↑.
分析 (1)中子数=质量数-质子数,离子结构中只有1个电子层,最外层电子数为2;
(2)由难溶于水,其熔融物难电离可知,该物质由分子构成,不含离子;
(3)铍与NaOH溶液反应,类似Al与NaOH反应生成盐和氢气.
解答 解:(1)13Be2+的中子数为13-4=9,其结构示意图为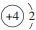 ,故答案为:9;
,故答案为:9; ;
;
(2)由难溶于水,其熔融物难电离可知,该物质由分子构成,不含离子,则BeO的化学键类型为共价键,故答案为:共价键;
(3)铍与NaOH溶液反应的离子方程式为Be+2OH-=BeO22-+H2↑,故答案为:Be+2OH-=BeO22-+H2↑.
点评 本题考查离子反应方程式的书写及原子构成等,为高频考点,把握信息及发生的反应为解答的关键,侧重分析与迁移应用能力的考查,注意类推的规律,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
5.有四瓶澄清透明的溶液:①MgCl2溶液;②Cu(NO3)2溶液;③K2SO4溶液;④NaOH溶液.不用其他试剂即可将它们一一鉴别出来,鉴别出来的顺序是( )
| A. | ④②①③ | B. | ①④③② | C. | ②③①④ | D. | ②④①③ |
9.下列说法正确的是( )
| A. | 液氨是非电解质,但液态氯化氢是强电解质 | |
| B. | 体积不同但pH相同的醋酸和盐酸,用蒸馏水分别稀释至原体积的m倍和n倍后两溶液的pH值仍相同,m和n的相对大小无法确定 | |
| C. | CuCl2+2H2O═Cu(OH)2+2HCl,加入少量硝酸银固体后可以增大CuCl2水解程度 | |
| D. | I-、K+、Na+、NO3-、Cl-一定可以在甲基橙呈黄色的溶液中大量共存 |
19.描述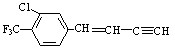 分子的下列叙述中,错误的是( )
分子的下列叙述中,错误的是( )
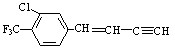 分子的下列叙述中,错误的是( )
分子的下列叙述中,错误的是( )| A. | 该物质使酸性高锰酸钾溶液褪色 | |
| B. | 一分子该物质能与6分子H2加成 | |
| C. | 最多有18个原子可能处在同一平面上 | |
| D. | 分子式为C11H6ClF3 |
6. 结合下表回答下列问题(均为25℃时的数据)
结合下表回答下列问题(均为25℃时的数据)
(1)上述五种酸中,酸性最强的是HNO2 (填化学式).HCO3-的电离平衡常数表达式K=$\frac{c(C{{O}_{3}}^{2-})•c({H}^{+})}{c(HC{{O}_{3}}^{-})}$.
(2)已知硼酸(H3BO3)与足量NaOH溶液发生酸碱中和反应的离子方程式为:
H3BO3+OH-=B(OH)4-,则硼酸为一元酸,硼酸的电离方程式为H3BO3+H2O?B(OH)4-+H+.
(3)常温下,0.01mol•L-1的HNO2 溶液加水稀释的过程中,下列各项数据增大的是④⑤(填代号).
①c(H+ ) ②c(NO2- )/c(H+) ③Ka(HNO2)
④c(H+ )/c(HNO2) ⑤c(OH -) ⑥$\frac{c({NO}_{2}^{-})}{c(H{NO}_{2})•c{(OH}^{-})}$
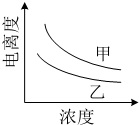
(4)如图描述的是醋酸与HNO2 在水中的电离度与浓度关系,其中反应醋酸的是曲线乙 (填“甲”或“乙”,已知:电离度=已电离的溶质分子数/原有溶质分子总数).
(5)根据表中提供的数据可知,在溶液中能大量共存的微粒组是d (填代号).
a.H2CO3、HCO3-、CH3COO-、CN- b.HCO3-、CH3COOH、CN-、CO32-
c.HCN、HCO3-、CN-、CO32-d.HCN、HCO3-、CH3COO-、CN-
(6)设计一个现象明显、操作简便的实验方案证明HNO2酸性强于碳酸(不用叙述仪器和具体操作).
 结合下表回答下列问题(均为25℃时的数据)
结合下表回答下列问题(均为25℃时的数据)| 酸 | 电离平衡常数(Ka) | 酸 | 电离平衡常数(Ka) |
| CH3COOH | 1.7×10-5 | H3BO3 | 5.8×10-10 |
| H2CO3 | Ka1=4.2×10-7 Ka2=5.6×10-11 | HNO2 | 7.1×10-4 |
| HCN | 6.2×10-10 |
(2)已知硼酸(H3BO3)与足量NaOH溶液发生酸碱中和反应的离子方程式为:
H3BO3+OH-=B(OH)4-,则硼酸为一元酸,硼酸的电离方程式为H3BO3+H2O?B(OH)4-+H+.
(3)常温下,0.01mol•L-1的HNO2 溶液加水稀释的过程中,下列各项数据增大的是④⑤(填代号).
①c(H+ ) ②c(NO2- )/c(H+) ③Ka(HNO2)
④c(H+ )/c(HNO2) ⑤c(OH -) ⑥$\frac{c({NO}_{2}^{-})}{c(H{NO}_{2})•c{(OH}^{-})}$
(4)如图描述的是醋酸与HNO2 在水中的电离度与浓度关系,其中反应醋酸的是曲线乙 (填“甲”或“乙”,已知:电离度=已电离的溶质分子数/原有溶质分子总数).
(5)根据表中提供的数据可知,在溶液中能大量共存的微粒组是d (填代号).
a.H2CO3、HCO3-、CH3COO-、CN- b.HCO3-、CH3COOH、CN-、CO32-
c.HCN、HCO3-、CN-、CO32-d.HCN、HCO3-、CH3COO-、CN-
(6)设计一个现象明显、操作简便的实验方案证明HNO2酸性强于碳酸(不用叙述仪器和具体操作).
4.下列各组离子在指定溶液中一定能大量共存的是( )
| A. | c(H+ )=1.0×10-13mol/L溶液:C6H5O-、K+、SO42-、Br- | |
| B. | 能使紫色石蕊变红的溶液中:NO3-、I-、Ba2+、AlO2- | |
| C. | pH=2的溶液中:Na+、S2-、HCO3-、Ca2+ | |
| D. | 能与金属铝反应放出氢气的溶液:K+ NO3- SO42- NH4+ |

 .
. 的沸点高.(填高或低)
的沸点高.(填高或低)