题目内容
15.只要用一种试剂,可区别NaCl、MgSO4、FeCl2、FeCl3四种溶液,这种试剂是( )| A. | HCl | B. | NaOH | C. | AgNO3 | D. | BaCl2 |
分析 NaCl、MgSO4、FeCl2、FeCl3四种溶液分别与NaOH反应的现象为:无现象、白色沉淀、白色沉淀变为灰绿色最后为红褐色、红褐色沉淀,以此来解答.
解答 解:A.均与HCl不反应,不能鉴别,故A不选;
B.NaCl、MgSO4、FeCl2、FeCl3四种溶液分别与NaOH反应的现象为:无现象、白色沉淀、白色沉淀变为灰绿色最后为红褐色、红褐色沉淀,可鉴别,故B选;
C.均与硝酸银反应生成白色沉淀,不能鉴别,故C不选;
D.只有MgSO4与氯化钡反应,不能鉴别,故D不选;
故选B.
点评 本题考查物质的检验和鉴别,为高频考点,把握物质性质及其性质差异性是解本题关键,注意亚铁离子与氢氧根离子反应现象,题目难度不大.

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案
相关题目
16.硫酸是重要的化工原料,生产过程中SO2催化氧化生成SO3的化学反应为:2SO2(g)+O2(g)$\frac{\underline{催化剂}}{△}$2SO3(g).
(1)实验测得SO2反应生成SO3的转化率与温度、压强有关,请根据表信息,结合工业生产实际,选择最合适的生产条件是400℃,1个标准大气压.
(2)反应2SO2(g)+O2(g)$\frac{\underline{催化剂}}{△}$2SO3(g)达到平衡后,改变下列条件,能使SO2(g)平衡时的浓度比原来减小的是AC(填字母).
A.保持温度和容器体积不变,充入1mol O2(g)
B.保持温度和容器体积不变,充入2mol SO3 (g)
C.降低温度
D.在其他条件不变时,减小容器的容积.
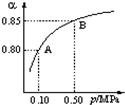
(3)某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如图所示,2.0mol SO2和1.0mol O2置于10L密闭容器中,反应达平衡后,体系总压强为0.10MPa.平衡状态由A编导B时,平衡常数K(A)=K(B)(填“<”,“>”,或“=”),B点的化学平衡常数是800.
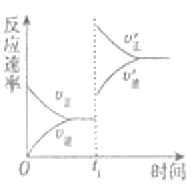
 (4)在一个固定容器为5L的密闭容器中充入0.20mol SO2(g)和0.10mol O2(g),t1时刻达到平衡,测得容器中含SO30.18mol.①t1时刻达到平衡后,改变一个条件使化学反应速度发生如图所示的变化,则改变的条件是C.
(4)在一个固定容器为5L的密闭容器中充入0.20mol SO2(g)和0.10mol O2(g),t1时刻达到平衡,测得容器中含SO30.18mol.①t1时刻达到平衡后,改变一个条件使化学反应速度发生如图所示的变化,则改变的条件是C.
A.体积不变,向容器中通入少量O2
B.体积不变,向容器中通入少量SO2
C.缩小容器体积
D.升高温度
E.体积不变,向容器中通入少量氮气
②若继续通入0.20mol SO2和0.10mol O2,则平衡向正反应方向移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,0.36 mol<n(SO3)<0.40mol.
(1)实验测得SO2反应生成SO3的转化率与温度、压强有关,请根据表信息,结合工业生产实际,选择最合适的生产条件是400℃,1个标准大气压.
| 压强 SO2转化率 温度 | 1个大气压 | 5个大气压 | 10个大气压 | 15个大气压 |
| 400℃ | 0.9961 | 0.9972 | 0.9984 | 0.9988 |
| 500℃ | 0.9675 | 0.9767 | 0.9852 | 0.9894 |
| 600℃ | 0.8520 | 0.8897 | 0.9276 | 0.9468 |
A.保持温度和容器体积不变,充入1mol O2(g)
B.保持温度和容器体积不变,充入2mol SO3 (g)
C.降低温度
D.在其他条件不变时,减小容器的容积.
(3)某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如图所示,2.0mol SO2和1.0mol O2置于10L密闭容器中,反应达平衡后,体系总压强为0.10MPa.平衡状态由A编导B时,平衡常数K(A)=K(B)(填“<”,“>”,或“=”),B点的化学平衡常数是800.
 (4)在一个固定容器为5L的密闭容器中充入0.20mol SO2(g)和0.10mol O2(g),t1时刻达到平衡,测得容器中含SO30.18mol.①t1时刻达到平衡后,改变一个条件使化学反应速度发生如图所示的变化,则改变的条件是C.
(4)在一个固定容器为5L的密闭容器中充入0.20mol SO2(g)和0.10mol O2(g),t1时刻达到平衡,测得容器中含SO30.18mol.①t1时刻达到平衡后,改变一个条件使化学反应速度发生如图所示的变化,则改变的条件是C.A.体积不变,向容器中通入少量O2
B.体积不变,向容器中通入少量SO2
C.缩小容器体积
D.升高温度
E.体积不变,向容器中通入少量氮气
②若继续通入0.20mol SO2和0.10mol O2,则平衡向正反应方向移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,0.36 mol<n(SO3)<0.40mol.

6.在K2Cr2O7溶液中存在下列平衡:2CrO42- (黄色)+2H+?Cr2O72- (橙色)+H2O中,溶液颜色介于黄色和橙色之间,今欲使溶液橙色变浅,可以在溶液中加入( )
①H+ ②OH- ③K+ ④H2O.
①H+ ②OH- ③K+ ④H2O.
| A. | ①③ | B. | ②④ | C. | ①④ | D. | ②③ |
10.已知重铬酸钾(K2Cr2O7)溶液中存在如下平衡:Cr2O72-(橙色)+H2O?2H++2CrO42- (黄色)
①向2mL 0.1mol•L-1 K2Cr2O7溶液中滴入3滴6mol•L-1NaOH溶液,溶液由橙色变为黄色;向所得溶液中再滴入5滴浓H2SO4,溶液由黄色变为橙色.
②向2mL 0.1mol•L-1 酸化的K2Cr2O7溶液中滴入适量(NH4)2Fe(SO4)2溶液,溶液由橙色变为绿色,发生反应:Cr2O72-+14H++6Fe2+?2Cr3+(绿色)+6Fe3++7H2O.下列分析正确的是( )
①向2mL 0.1mol•L-1 K2Cr2O7溶液中滴入3滴6mol•L-1NaOH溶液,溶液由橙色变为黄色;向所得溶液中再滴入5滴浓H2SO4,溶液由黄色变为橙色.
②向2mL 0.1mol•L-1 酸化的K2Cr2O7溶液中滴入适量(NH4)2Fe(SO4)2溶液,溶液由橙色变为绿色,发生反应:Cr2O72-+14H++6Fe2+?2Cr3+(绿色)+6Fe3++7H2O.下列分析正确的是( )
| A. | 实验①和②均能证明K2Cr2O7溶液中存在上述平衡 | |
| B. | 实验②能说明氧化性:Cr2O72->Fe3+ | |
| C. | CrO42- 和Fe2+在酸性溶液中可以大量共存 | |
| D. | 稀释K2Cr2O7溶液时,溶液中各离子浓度均减小 |
20. 用铅蓄电池电解甲、乙电解池中的溶液.已知铅蓄电池的总反应为:Pb+PbO2+2H2SO4═2PbSO4+2H2O,电解一段时间后向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是( )
用铅蓄电池电解甲、乙电解池中的溶液.已知铅蓄电池的总反应为:Pb+PbO2+2H2SO4═2PbSO4+2H2O,电解一段时间后向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是( )
 用铅蓄电池电解甲、乙电解池中的溶液.已知铅蓄电池的总反应为:Pb+PbO2+2H2SO4═2PbSO4+2H2O,电解一段时间后向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是( )
用铅蓄电池电解甲、乙电解池中的溶液.已知铅蓄电池的总反应为:Pb+PbO2+2H2SO4═2PbSO4+2H2O,电解一段时间后向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是( )| A. | d极为阴极 | |
| B. | 放电时铅蓄电池负极的电极反应式为:PbO2+4H++SO42-+4e-═PbSO4+2H2O | |
| C. | 若利用甲池精炼铜,b极应为粗铜 | |
| D. | 若电极材料均为石墨,当析出6.4g Cu时,两池共产生气体3.36L(标准状况下) |
5.有四瓶澄清透明的溶液:①MgCl2溶液;②Cu(NO3)2溶液;③K2SO4溶液;④NaOH溶液.不用其他试剂即可将它们一一鉴别出来,鉴别出来的顺序是( )
| A. | ④②①③ | B. | ①④③② | C. | ②③①④ | D. | ②④①③ |


 .
. 的沸点高.(填高或低)
的沸点高.(填高或低)