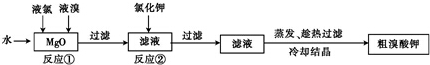
题目内容
6.25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )| A. | 0.1 mol•L-1 CH3COONa溶液与0.1 mol•L-1HCl溶液等体积混合:c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-) | |
| B. | 0.1 mol•L-1 NH4Cl溶液与0.1 mol•L-1氨水等体积混合(pH>7):c(NH3•H2O)>c(NH4+)>c(Cl-)>c(OH-) | |
| C. | 0.1 mol•L-1Na2CO3溶液与0.1 mol•L-1NaHCO3溶液等体积混合:$\frac{3}{2}$c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| D. | 0.1 mol•L-1Na2C2O4溶液与0.1 mol•L-1HCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O42-)+c(OH-)=c(Na+)+c(H+) |
分析 A.0.1 mol•L-1 CH3COONa溶液与0.1 mol•L-1HCl溶液等体积混合,溶质为醋酸和氯化钠,醋酸为弱酸部分电离;
B.0.1 mol•L-1 NH4Cl溶液与0.1 mol•L-1氨水等体积混合(pH>7),溶液显碱性说明一水合氨电离程度大于铵根离子的水解程度;
C.0.1 mol•L-1Na2CO3溶液与0.1 mol•L-1NaHCO3溶液等体积混合溶液中存在物料守恒,2n(Na)=3n(C),钠离子总物质的量等于碳元素所有存在形式总和
D.0.1 mol•L-1Na2C2O4溶液与0.1 mol•L-1HCl溶液等体积混合得到等浓度NaCl和NaHC2O4,溶液中存在电荷守恒.
解答 解:A.0.1 mol•L-1 CH3COONa溶液与0.1 mol•L-1HCl溶液等体积混合,溶质为醋酸和氯化钠,醋酸为弱酸部分电离c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-),故A正确;
B.0.1 mol•L-1 NH4Cl溶液与0.1 mol•L-1氨水等体积混合(pH>7),溶液显碱性说明一水合氨电离程度大于铵根离子的水解程度,c(NH3•H2O)<c(NH4+),故B错误:
C.0.1 mol•L-1Na2CO3溶液与0.1 mol•L-1NaHCO3溶液等体积混合溶液中存在物料守恒,2n(Na)=3n(C),钠离子总物质的量等于碳元素所有存在形式总和,2c(Na+)=3[c(CO32-)+c(HCO3-)+c(H2CO3)],则C错误;
D.0.1 mol•L-1Na2C2O4溶液与0.1 mol•L-1HCl溶液等体积混合得到等浓度NaCl和NaHC2O4,溶液中存在电荷守恒,2c(C2O42-)+c(HC2O4-)+c(OH-)+c(Cl-)=c(Na+)+c(H+),故D错误;
故选A.
点评 本题考查了化学反应后溶液酸碱性比较、电解质溶液中离子浓度大小比较、溶液中电荷守恒和物料守恒的计算应用等,掌握基础是解题关键,题目难度中等.

 孟建平名校考卷系列答案
孟建平名校考卷系列答案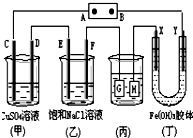 如图所示的装置,C、D、E、F、X、Y都是惰性电极.将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色.则以下说法正确的是( )
如图所示的装置,C、D、E、F、X、Y都是惰性电极.将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色.则以下说法正确的是( )| A. | 电源B极是正极 | |
| B. | 装置(丁)中Y极附近红褐色变深,说明氢氧化铁胶粒带正电荷 | |
| C. | 欲用(丙)装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液 | |
| D. | (甲)、(乙)装置的C、D、E、F电极均有单质生成,其物质的量之比为1:2:2:2 |
| A. | 酸性强弱:HClO4>H2SO4>H3PO4 | B. | 离子半径:Na+>Mg2+>Al3+>F- | ||
| C. | 热稳定性:HCl>H2S>PH3>SiH4 | D. | 熔点:SiO2>NaCl>I2>CO2 |
| A. | 侯氏制碱法的基本原理:Na++NH3+H2O+CO2=NaHCO3↓+NH4+ | |
| B. | 向KAl(SO4)2溶液中加入Ba(OH)2溶液至中性:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ | |
| C. | 硫酸亚铁溶液中滴加酸化的双氧水:2Fe2++2H++H2O2=2Fe3++2H2O | |
| D. | 向漂白粉溶液中通入少量的SO2气体:Ca2++2ClO-+H2O+SO2=CaSO3↓+2HClO |
 现有六种元素,其中B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题
现有六种元素,其中B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题| B元素原子的核外p电子数比s电子数少1 |
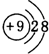
| C原子的第一至第四电离能分别是: I1=738kJ/mol I2=1451kJ/mol I3=7733kJ/mol I4=10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F 是前四周期原子电子轨道表示式中单电子数最多的元素 |
| G在周期表的第十一列 |
(2)C和与其左右相邻元素原子的第一电离能由大到小的顺序是Mg>Al>Na.
(3)①DE3中心原子的杂化方式为sp3杂化,该分子中的键角比离子DE4+中的键角小的原因是孤电子对与成键电子对的排斥作用力大于成键电子对之间的排斥作用力
②将E的单质通入到黄血盐{K4[Fe(CN)6]}溶液中,可得到赤血盐{K3[Fe(CN)6]}.该反应的离子方程式为[Fe(CN)6]4-+Cl2=2[Fe(CN)6]3-+2Cl-
③已知含E的一种化合物与过氧化氢发生如下反应(已配平):H2O2+
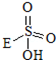 →
→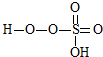 +HE (请写出横线上物质的结构式)
+HE (请写出横线上物质的结构式)(4)F位于d区,价电子排布式为3d54s1.
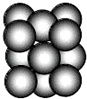
(5)G单质晶体中原子的堆积方式为面心立方最密堆积(如图),则晶胞中每个原子的配位数为12.假设晶胞边长为a,原子半径为r,列式表示该晶胞的空间利用率为$\frac{\sqrt{2}π}{6}$.
| A. | Si→SiO2→H2SiO3→Na2SiO3 | B. | Na→Na2O2→Na2CO3→NaCl | ||
| C. | Fe→FeCl3→Fe(OH)3→Fe2O3 | D. | Al→Al2O3→AlCl3→Al(OH)3 |
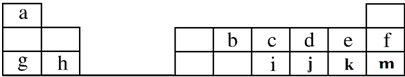
 ,元素d与元素g形成的原子个数比为1:1的化合物的电子式为
,元素d与元素g形成的原子个数比为1:1的化合物的电子式为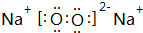 ;(用元素符号填空)
;(用元素符号填空)