题目内容
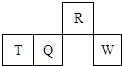 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )| A、原子半径一定是:T>Q>R |
| B、最高价氧化物对应水化物的酸性一定是:Q<W |
| C、含T的盐溶液一定显酸性 |
| D、最简单气态氢化物的热稳定性一定是:R>Q |
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:短周期元素R、T、Q、W,根据元素所处的位置,可确定T、Q、W为第三周期的元素,R为第二周期元素,T所处的周期序数与族序数相等,则T为Al元素,故Q为Si元素,W为S元素,R为N元素,据此结合选项解答.
解答:
解:A、同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:T>Q>R,故A正确;
B、非金属性Si<S,故最高价氧化物对应水化物的酸性为H2SiO3<H2SO4,故B正确;
C、铝盐溶液呈酸性,但偏铝酸盐溶液呈碱性,故C错误;
D、非金属性N>Si,故最简单气态氢化物的热稳定性为NH3>SiH4,故D正确;
故选C.
B、非金属性Si<S,故最高价氧化物对应水化物的酸性为H2SiO3<H2SO4,故B正确;
C、铝盐溶液呈酸性,但偏铝酸盐溶液呈碱性,故C错误;
D、非金属性N>Si,故最简单气态氢化物的热稳定性为NH3>SiH4,故D正确;
故选C.
点评:本题主要是元素“位、构、性”三者关系的综合考查,比较全面考查学生有关元素推断知识,难度中等.

练习册系列答案
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案
相关题目
如图所示,其中甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O下列说法正确的是( )
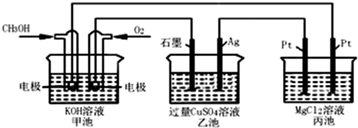

| A、甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置 |
| B、甲池通入CH3OH的电极反应为CH3OH-6e?+2H2O═CO32?+8H+ |
| C、反应一段时间后,向乙池中加入一定量Cu(OH)2固体,能使CuSO4溶液恢复到原浓度 |
| D、甲池中消耗224 mL(标准状况下)O2,此时乙池中银电极上产生1.28g固体 |
人体最重要的供能物质是( )
| A、蛋白质 | B、糖类 |
| C、脂肪 | D、维生素 |
分子式C3H6Cl2的氯代烷分子中的一个氢原子被氯原子取代后,可得到两种同分异构体,则C3H6Cl2的名称是( )
| A、1,3-二氯丙烷 |
| B、1,1-二氯丙烷 |
| C、1,2-二氯丙烷 |
| D、2,2-二氯丙烷 |
将一定量的钠铝合金置于水中,合金全部溶解,往溶液中加入1mol/L盐酸20mL,此时沉淀量达到最大值,则原合金中钠的质量为( )
| A、0.46g |
| B、0.02g |
| C、0.80g |
| D、0.23g |
下列说法中正确的是( )
| A、废电池必须集中处理的首要原因是回收其中的各种金属、石墨电极及塑料包装等 |
| B、向煤燃料中加入生石灰,可以减少二氧化硫对大气的污染 |
| C、氟利昂可以破坏臭氧层,从而导致温室效应 |
| D、绿色食品是指使用过化肥和农药生产出来的农副产品 |
过量铁粉和100mL 2mol?L-1的硫酸溶液反应,一定温度下,为了减缓反应的速率,又不影响产生H2的总量,可向反应物中加入适量的( )
| A、碳酸钠固体 |
| B、把稀硫酸改为浓硫酸 |
| C、硫酸钾稀溶液 |
| D、铜粉 |
下列有关叙述正确的是( )
| A、高温下进行的反应都是吸热反应,常温下能够进行的反应都是放热反应 |
| B、实验室用4mol SO2与2mol O2进行下列反应:2SO2(g)+O2(g)?2SO3(g)△H=-196.64kJ/mol,当放出314.624kJ热量时,SO2的转化率为80% |
| C、常温下,向纯水中通入一定量二氧化硫,则水的电离平衡被促进 |
| D、向3mL0.1mol/LAgNO3溶液中滴入5滴0.1mol/L NaCl溶液产生白色沉淀,再滴入KI稀溶液沉淀显黄色,则KSP(AgI)<KSP(AgCl) |