题目内容
过量铁粉和100mL 2mol?L-1的硫酸溶液反应,一定温度下,为了减缓反应的速率,又不影响产生H2的总量,可向反应物中加入适量的( )
| A、碳酸钠固体 |
| B、把稀硫酸改为浓硫酸 |
| C、硫酸钾稀溶液 |
| D、铜粉 |
考点:化学反应速率的影响因素
专题:化学反应速率专题
分析:Fe过量,则生成氢气由硫酸决定,为了减慢反应速率,且不影响生成氢气的总量,可减小氢离子的浓度,但不能改变硫酸的物质的量,以此来解答.
解答:
解:A.加入Na2CO3,消耗硫酸,溶液生成氢气的总量减小,故A错误;
B.把稀硫酸改为浓硫酸,与Fe发生氧化还原反应不生成氢气,故B错误;
C.硫酸钾稀溶液不参加反应,但总体积增大,氢离子物质的量不变,则减缓反应的速率,又不影响产生H2的总量,故C正确;
D.加Cu粉,形成原电池反应,反应速率增大,故D错误;
故选C.
B.把稀硫酸改为浓硫酸,与Fe发生氧化还原反应不生成氢气,故B错误;
C.硫酸钾稀溶液不参加反应,但总体积增大,氢离子物质的量不变,则减缓反应的速率,又不影响产生H2的总量,故C正确;
D.加Cu粉,形成原电池反应,反应速率增大,故D错误;
故选C.
点评:本题考查影响反应速率的因素,为高频考点,注意Fe过量,生成氢气由硫酸决定,把握浓度、温度对反应速率的影响即可解答,选择B为易错点,题目难度不大.

练习册系列答案
相关题目
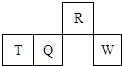 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )| A、原子半径一定是:T>Q>R |
| B、最高价氧化物对应水化物的酸性一定是:Q<W |
| C、含T的盐溶液一定显酸性 |
| D、最简单气态氢化物的热稳定性一定是:R>Q |
将氯化铝溶液蒸干并灼烧后得到纯净的固体A,将A在高温下熔融后用铂电极进行电解,下列有关电极产物的判断正确的是( )
| A、阴极产物是氢气 |
| B、阳极产物是氧气 |
| C、阴极产物是铝和氧气 |
| D、阳极产物只有氯气 |
某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )
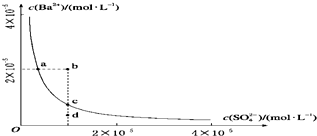

| A、加入Na2SO4可以使溶液由a点变到c点 |
| B、通过蒸发可以使溶液由d点变到c点 |
| C、b、d点都是不能长时间稳定存在的点 |
| D、a点对应的Ksp大于c点对应的Ksp |
下列物质溶于水时会破坏水的电离平衡,且属于电解质的是( )
| A、氯气 | B、二氧化硫 |
| C、碘化钾 | D、碳酸钠 |
下列物质中,属于电解质的是( )
| A、CO2 |
| B、H2 |
| C、Na2SO4 |
| D、Cu |