题目内容
写出下列反应的热化学方程式
N2(g)与适量H2(g)反应生成1molNH3(g),放出46.2kJ的热量; .
N2(g)与适量H2(g)反应生成1molNH3(g),放出46.2kJ的热量;
考点:热化学方程式
专题:化学反应中的能量变化
分析:N2和H2完全反应生成1molNH3放热46.2kJ热量,生成2mol氨气放热92.4KJ,反应为放热反应,反应的焓变为-92.4KJ/mol,依据热化学方程式书写得到.
解答:
解:N2和H2完全反应生成1molNH3放热46.2kJ热量,生成2mol氨气放热92.4KJ,反应为放热反应,反应的焓变为-92.4KJ/mol,反应的热化学方程式为:N2(g)+3H2(g)=2NH3(g)△H=-92.4KJ/mol;
故答案为:N2(g)+3H2(g)=2NH3(g)△H=-92.4KJ/mol.
故答案为:N2(g)+3H2(g)=2NH3(g)△H=-92.4KJ/mol.
点评:本题考查了热化学方程式的书写方法和注意问题,掌握基础是解题关键,注意焓变与化学计量数间的关系,题目较简单.

练习册系列答案
相关题目
除去括号内杂质所用试剂和方法不正确的是( )
| A、Cu(Fe)---加盐酸,过滤 |
| B、NaCl溶液(碘)----CCl4,萃取、分液 |
| C、KNO3溶液(NaCl)----降温结晶,过滤 |
| D、CO2(HCl)----饱和碳酸钠溶液,洗气 |
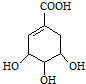
下图是一种农药生产中间体的结构简式,下列关于这种中间体的叙述中正确的是( )

| A、属于芳香烃 |
| B、一定条件下可发生置换、加成反应、取代、酯化、水解、消去反应 |
| C、一定条件下1 mol该中间体最多可与含5 molNaOH的溶液反应 |
| D、一定条件下1 mol该中间体最多可与4 molH2反应 |
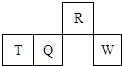 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )| A、原子半径一定是:T>Q>R |
| B、最高价氧化物对应水化物的酸性一定是:Q<W |
| C、含T的盐溶液一定显酸性 |
| D、最简单气态氢化物的热稳定性一定是:R>Q |
我国城市环境中的大气污染物主要是( )
| A、O3、Cl2、HCl、酸雨 |
| B、SO2、NO2、CO、烟尘 |
| C、NH3、CO、CO2、雾 |
| D、HCl、SO2、N2、粉尘 |
将氯化铝溶液蒸干并灼烧后得到纯净的固体A,将A在高温下熔融后用铂电极进行电解,下列有关电极产物的判断正确的是( )
| A、阴极产物是氢气 |
| B、阳极产物是氧气 |
| C、阴极产物是铝和氧气 |
| D、阳极产物只有氯气 |
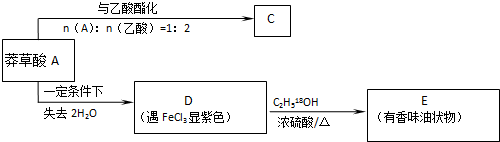
 如图所示:已知A和E为金属单质,B是化合物且常温下为液态,F为两性化合物.
如图所示:已知A和E为金属单质,B是化合物且常温下为液态,F为两性化合物.