题目内容
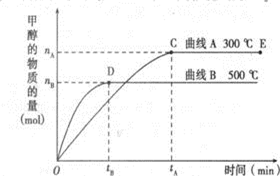 一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):
一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):根据题意完成下列各题:
(1)反应达到平衡时,平衡常数表达式K=
(2)500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=
(3)在其他条件不变的情况下,将处于E点的体系的体积压缩到原来的
| 1 |
| 2 |
a.氢气的浓度减少
b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加
d.重新平衡时n(H2)/n(CH3OH)增大
(4)可逆反应:CO(g)+2H2(g)?CH3OH(g) 在恒容密闭容器中反应,达到平衡状态的标志是:
①单位时间内生成2n molH2的同时生成n mol CH3OH
②单位时间内生成2n molH2 的同时,生成n mol CO
③用CO、H2、CH3OH 的物质的量浓度变化表示的反应速率的比为1:2:1的状态
④混合气体的密度不再改变的状态
⑤混合气体的平均相对分子质量不再改变的状态
(5)据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是:
考点:化学平衡常数的含义,化学平衡建立的过程,化学平衡状态的判断,物质的量或浓度随时间的变化曲线
专题:化学平衡专题
分析:(1)化学平衡常数K=
;升高温度,甲醇的物质的量减小,说明平衡向逆反应方向移动,则正反应是放热反应;
(2)500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=2v(CH3OH)=2
;
(3)将处于E点的体系的体积压缩到原来的
,体系的压强增大,平衡向正反应方向移动,正逆反应速率都增大;
(4)当正逆反应速率相等时,各物质的部分含量不变,则该反应达到平衡状态;
(5)二氧化碳能抑制氧化亚铜被还原.
| c(CH3OH) |
| c(CO).c2(H2) |
(2)500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=2v(CH3OH)=2
| ||
| △t |
(3)将处于E点的体系的体积压缩到原来的
| 1 |
| 2 |
(4)当正逆反应速率相等时,各物质的部分含量不变,则该反应达到平衡状态;
(5)二氧化碳能抑制氧化亚铜被还原.
解答:
解:(1)化学平衡常数K=
;升高温度,甲醇的物质的量减小,说明平衡向逆反应方向移动,则正反应是放热反应,化学平衡常数减小,故答案为:
;减小;
(2)500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=2v(CH3OH)=2
=2×
mol/(L.min)=
mol?l-1?min-1,故答案为:
;
(3)将处于E点的体系的体积压缩到原来的
,体系的压强增大,
a.体积减小,氢气的浓度增大,故错误;
b.体系压强增大,正逆反应速率都增大,故正确;
c.增大压强,平衡向正反应方向移动,则甲醇的物质的量增加,故正确;
d.增大压强,平衡向正反应方向移动,且氢气的转化率大于原来体系,所以重新平衡时n(H2)/n(CH3OH)减小,故错误;
故选bc;
(4)①单位时间内生成2n molH2的同时生成n mol CH3OH,说明该反应正逆反应速率相等,所以该反应达到平衡状态,故正确;
②无论该反应是否达到平衡,都存在单位时间内生成2n molH2 的同时,生成n mol CO,所以不能说明该反应达到平衡状态,故错误;
③用CO、H2、CH3OH 的物质的量浓度变化表示的反应速率的比为1:2:1的状态时,该反应不一定达到平衡状态,与初始浓度与转化率有关,所以不能判断是否达到平衡状态,故错误;
④无论该反应是否达到平衡状态,混合气体的密度都不再改变,所以不能据此判断是否达到平衡状态,故C错误;
⑤混合气体的平均相对分子质量不再改变的状态,说明各物质的物质的量不变,则该反应达到平衡状态,故正确;
故选①、⑤;
(5)该反应中存在Cu2O+CO?2Cu+CO2,当体系中含有二氧化碳时抑制该反应发生,所以有利于氧化亚铜的物质的量不变,故答案为:Cu2O+CO?2Cu+CO2.
| c(CH3OH) |
| c(CO).c2(H2) |
| c(CH3OH) |
| c(CO).c2(H2) |
(2)500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=2v(CH3OH)=2
| ||
| △t |
| ||
| tB |
| 2n(B) |
| 3t(B) |
| 2n(B) |
| 3t(B) |
(3)将处于E点的体系的体积压缩到原来的
| 1 |
| 2 |
a.体积减小,氢气的浓度增大,故错误;
b.体系压强增大,正逆反应速率都增大,故正确;
c.增大压强,平衡向正反应方向移动,则甲醇的物质的量增加,故正确;
d.增大压强,平衡向正反应方向移动,且氢气的转化率大于原来体系,所以重新平衡时n(H2)/n(CH3OH)减小,故错误;
故选bc;
(4)①单位时间内生成2n molH2的同时生成n mol CH3OH,说明该反应正逆反应速率相等,所以该反应达到平衡状态,故正确;
②无论该反应是否达到平衡,都存在单位时间内生成2n molH2 的同时,生成n mol CO,所以不能说明该反应达到平衡状态,故错误;
③用CO、H2、CH3OH 的物质的量浓度变化表示的反应速率的比为1:2:1的状态时,该反应不一定达到平衡状态,与初始浓度与转化率有关,所以不能判断是否达到平衡状态,故错误;
④无论该反应是否达到平衡状态,混合气体的密度都不再改变,所以不能据此判断是否达到平衡状态,故C错误;
⑤混合气体的平均相对分子质量不再改变的状态,说明各物质的物质的量不变,则该反应达到平衡状态,故正确;
故选①、⑤;
(5)该反应中存在Cu2O+CO?2Cu+CO2,当体系中含有二氧化碳时抑制该反应发生,所以有利于氧化亚铜的物质的量不变,故答案为:Cu2O+CO?2Cu+CO2.
点评:本题涉及化学平衡状态的判断、化学平衡移动的影响因素等知识点,根据方程式特点确定平衡移动影响因素,只有反应前后改变的物理量不变时才能作为化学平衡状态的判断依据,题目难度中等.

练习册系列答案
 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案
相关题目
化学在工业生产和日常生活中有着重要的应用.下列说法正确的是( )
| A、CO2、NO2和SO2都是酸性氧化物,都是大气污染物 |
| B、常温下,铁在浓硫酸、浓硝酸中均能发生钝化,均能用铁罐储运 |
| C、Na2O2、H2O2所含化学键完全相同,都能作供氧剂 |
| D、NaClO和明矾都能作消毒剂或净水剂,加入酚酞试液均显红色 |
下列关于药物的使用说法正确的是( )
| A、能用于治疗胃酸过多的抗酸药通常含有麻黄碱 |
| B、青霉素有解热镇痛的作用 |
| C、阿司匹林是最重要的抗生素 |
| D、碘酒能使蛋白质变性,是一种外用消毒药 |


 能源短缺是人类将要面临的一个重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
能源短缺是人类将要面临的一个重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.