题目内容
合成氨工业对国民经济和社会发展具有重要的意义.其原理为:
N2(g)+3H2?2NH3(g)△H=-92.4kJ/mol,据此回答以下问题:
(1)①该反应的化学平衡常数表达式为K= .
②根据温度对化学平衡的影响规律可知,对于该反应,温度越高,其平衡常数的值越 .
(2)某温度下,若把10mol N2与30mol H2置于体积为10L的密闭容器内,反应达到平衡状态时,测得混合气体中氨的体积分数为20%,则该温度下反应的K= (可用分数表示).
能说明该反应达到化学平衡状态的是 (填字母).
a.容器内的密度保持不变 b.容器内压强保持不变
c.v正(N2)=2v逆(NH3) d.混合气体中c(NH3)不变
(3)对于合成氨反应而言,下列有关图象一定正确的是(选填序号) .
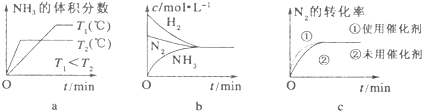
(4)相同温度下,有恒容密闭容器A和恒压密闭容器B,两容器中均充入1mol N2和3mol H2,此时两容器的体积相等.在一定条件下反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1kJ;B中NH3的体积分数为b,放出热量Q2kJ.则:a b(填“>”、“<”或“=”,下同),Q1 Q2,Q1 92.4.
N2(g)+3H2?2NH3(g)△H=-92.4kJ/mol,据此回答以下问题:
(1)①该反应的化学平衡常数表达式为K=
②根据温度对化学平衡的影响规律可知,对于该反应,温度越高,其平衡常数的值越
(2)某温度下,若把10mol N2与30mol H2置于体积为10L的密闭容器内,反应达到平衡状态时,测得混合气体中氨的体积分数为20%,则该温度下反应的K=
能说明该反应达到化学平衡状态的是
a.容器内的密度保持不变 b.容器内压强保持不变
c.v正(N2)=2v逆(NH3) d.混合气体中c(NH3)不变
(3)对于合成氨反应而言,下列有关图象一定正确的是(选填序号)

(4)相同温度下,有恒容密闭容器A和恒压密闭容器B,两容器中均充入1mol N2和3mol H2,此时两容器的体积相等.在一定条件下反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1kJ;B中NH3的体积分数为b,放出热量Q2kJ.则:a
考点:化学平衡常数的含义,化学平衡的影响因素,化学平衡状态的判断
专题:化学平衡专题
分析:(1)①依据平衡常数概念和化学方程式书写平衡常数表达式,用生成物平衡浓度的幂次方乘积除以反应物平衡浓度的幂次方乘积;
②反应是放热反应,升温,平衡逆向进行,平衡常数减小;
(2)依据化学平衡三段式列式计算平衡浓度,结合平衡常数概念计算得到;平衡标志是正逆反应速率相同,各组分含量保持不变分析选项;
(3)a.先出现拐点的先达到平衡,则T2大,温度高,平衡逆向移动;
b.平衡时浓度不一定相等;
c.使用催化剂加快反应速率,对平衡无影响;
(4)恒容密闭容器A,反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1kJ,
而恒压密闭容器B,均充入1mol N2和3molH2,反应发生后总物质的量减少,由pV=nRT可知,相对于A来说,相当于B加压,则平衡正向移动.
②反应是放热反应,升温,平衡逆向进行,平衡常数减小;
(2)依据化学平衡三段式列式计算平衡浓度,结合平衡常数概念计算得到;平衡标志是正逆反应速率相同,各组分含量保持不变分析选项;
(3)a.先出现拐点的先达到平衡,则T2大,温度高,平衡逆向移动;
b.平衡时浓度不一定相等;
c.使用催化剂加快反应速率,对平衡无影响;
(4)恒容密闭容器A,反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1kJ,
而恒压密闭容器B,均充入1mol N2和3molH2,反应发生后总物质的量减少,由pV=nRT可知,相对于A来说,相当于B加压,则平衡正向移动.
解答:
解:(1)①K为生成物浓度幂之积与反应物浓度幂之积的比,则K=
,故答案为:
;
②该反应为放热反应,升高温度,平衡逆向移动,则平衡常数K减小,温度越高,K越小,故答案为:小;
(2)设氮气消耗物质的量为x
N2(g)+3H2(g)?2NH3(g)
开始 1 3 0
转化 x 3x 2x
平衡1-x 3-3x 2x
平衡混合气体中氨的体积分数为20%,
×100%=20%,
解得x=
,平衡常数K=
=
,
由平衡的特征“等”、“定”可判定平衡,则
a.容器的体积、气体的质量始终不变,则容器内的密度保持不变,不能判断平衡,故a错误;
b.该反应为反应前后体积不等的反应,则容器内压强保持不变,达到平衡,故b正确;
c.υ正(N2)=2υ逆(NH3),正逆反应速率不等,反应没有达到平衡,故c错误;
d.混合气体中 c(NH3)不变,为平衡的特征,达到平衡,故d正确;
故答案为:
;bd;
(3)a.先出现拐点的先达到平衡,则T2大,温度高,平衡逆向移动,与图象一致,故a正确;
b.平衡时浓度不一定相等,平衡浓度取决起始浓度和转化率,图象表示错误,故b错误;
c.使用催化剂加快反应速率,对平衡无影响,平衡时物质的浓度不变,与图象一致,故c正确;
故答案为:ac;
(4)恒容密闭容器A,反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1kJ,
而恒压密闭容器B,均充入1mol N2和3molH2,反应发生后总物质的量减少,由pV=nRT可知,相对于A来说,相当于B加压,则平衡正向移动,氨气的体积分数变大,所以a<b,B中放出的热量对,则Q1<Q2,热化学方程式中反应热为完全反应放出的热量,而A中不能完全转化,放出的热量少,则Q1<92.4,
故答案为:<;<;<.
| c2(NH3) |
| c(N2)c3(H2) |
| c2(NH3) |
| c(N2)c3(H2) |
②该反应为放热反应,升高温度,平衡逆向移动,则平衡常数K减小,温度越高,K越小,故答案为:小;
(2)设氮气消耗物质的量为x
N2(g)+3H2(g)?2NH3(g)
开始 1 3 0
转化 x 3x 2x
平衡1-x 3-3x 2x
平衡混合气体中氨的体积分数为20%,
| 2x |
| 1-x+3-3x+2x |
解得x=
| 1 |
| 3 |
(
| ||||
(1-
|
| 1 |
| 12 |
由平衡的特征“等”、“定”可判定平衡,则
a.容器的体积、气体的质量始终不变,则容器内的密度保持不变,不能判断平衡,故a错误;
b.该反应为反应前后体积不等的反应,则容器内压强保持不变,达到平衡,故b正确;
c.υ正(N2)=2υ逆(NH3),正逆反应速率不等,反应没有达到平衡,故c错误;
d.混合气体中 c(NH3)不变,为平衡的特征,达到平衡,故d正确;
故答案为:
| 1 |
| 12 |
(3)a.先出现拐点的先达到平衡,则T2大,温度高,平衡逆向移动,与图象一致,故a正确;
b.平衡时浓度不一定相等,平衡浓度取决起始浓度和转化率,图象表示错误,故b错误;
c.使用催化剂加快反应速率,对平衡无影响,平衡时物质的浓度不变,与图象一致,故c正确;
故答案为:ac;
(4)恒容密闭容器A,反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1kJ,
而恒压密闭容器B,均充入1mol N2和3molH2,反应发生后总物质的量减少,由pV=nRT可知,相对于A来说,相当于B加压,则平衡正向移动,氨气的体积分数变大,所以a<b,B中放出的热量对,则Q1<Q2,热化学方程式中反应热为完全反应放出的热量,而A中不能完全转化,放出的热量少,则Q1<92.4,
故答案为:<;<;<.
点评:本题考查较综合,涉及化学平衡的计算、影响反应速率及平衡的因素、平衡的判定、热化学反应方程式,化学平衡图象等,注重高考常考查点的考查,注意图象的分析,题目难度中等.

练习册系列答案
相关题目
下列说法正确的是( )
| A、“辽宁舰”上用于舰载机降落拦阻索的特种钢缆,属于新型无机非金属材料 |
| B、“雾霾天气”、“温室效应”、“光化学烟雾”的形成都与氮氧化物无关 |
| C、白酒中混有少量塑化剂,少量饮用对人体无害,可通过过滤方法除去 |
| D、高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路” |
设NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A、常温常压下,11.2 L氧气所含的原子数为NA |
| B、1.8g的NH4+离子中含有的电子数为10NA |
| C、常温常压下,48g O3含有的氧原子数为3NA |
| D、0.1mol/L的FeCl3溶液所含Cl-数目为0.3NA |


 能源短缺是人类将要面临的一个重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
能源短缺是人类将要面临的一个重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.